Späte Rübenfäule
Rhizoctone brun (franz.); Rhizoctonia root and crown rot (engl.)
wissenschaftlicher Name: Rhizoctonia solani J.G. Kühn (anamorph), Thanatephorus cucumeris (A.B. Frank) Donk (teleomorph)
Taxonomie: Fungi, Basidiomycota, Agaricomycotina, Agaricomycetes, Cantharellales, Ceratobasidiaceae
Rhizoctonia solani (Anastomosegruppe 2-2) ist der Erreger der Späten Rübenfäule. R. solani ist ein bodenbürtiger Krankheitserreger, der neben Zuckerrüben auch Sojabohnen, Ackerbohnen, Mais und verschiedene Gräser befällt. Der Pilz verursacht ein nesterweises Absterben der Pflanzen und damit Ertragsverluste. Befallene Rüben haben einen tieferen Zuckergehalt als gesunde Rüben. Die Einhaltung einer mehrjährigen Anbaupause von Zuckerrüben in der Fruchtfolge ist eine wichtige vorbeugende Massnahme. Warme Witterung und hohe Bodenfeuchte begünstigen den Befall mit R. solani.

 Abb. 1. Die Späte Rübenfäule wird durch Rhizoctonia solani verursacht, typisch ist ein nesterweises Absterben der Zuckerrübenpflanzen.
Abb. 1. Die Späte Rübenfäule wird durch Rhizoctonia solani verursacht, typisch ist ein nesterweises Absterben der Zuckerrübenpflanzen.
Schadbild
Ab Juli/August beginnen die Rübenblätter nesterweise zu welken (Abb. 1 und 2). Oft sind dunkelbraune Flecken an der Basis der Blattstiele zu erkennen. Die Blätter sterben ab, bleiben aber am Rübenkörper haften und legen sich sternförmig um die Rübe auf den Boden. Die Rübe versucht neue Blätter zu bilden, bevor sie abstirbt.
Unter der Erdoberfläche finden sich am Rübenkörper braun verfärbte, trockene Faulstellen, die oft von Myzel mit kleinen Sklerotien besetzt sind. Die Faulstellen sind rund bis oval, breiten sich oberflächlich sehr schnell aus, wachsen zusammen oder zeigen ein Muster, das an Sprossen einer Leiter erinnert. Befallene Rüben weisen im Endstadium oft tiefe Risse auf und sind deformiert. Ein Schnitt durch die Rüben zeigt, dass sich das gesunde Gewebe deutlich vom kranken abgegrenzt. Die Fäulnis ist anfänglich auf die äusserste Schicht der Rübe beschränkt, später dringt sie tief in das Gewebe ein. Die Fäule entwickelt sich von aussen nach innen.
Die Späte Rübenfäule tritt häufig in Fruchtfolgen mit Mais und Grünland auf.
Verwechslungsmöglichkeiten
Die Späte Rübenfäule kann leicht mit anderen Fäulen verwechselt werden.
- Die Herz- und Trockenfäule wird durch Bormangel verursacht. Diese beginnt oben in der Mitte des Rübenkörpers.
- Stock- und Stängelälchen (Ditylenchus dipsaci) verursachen eine Fäulnis am Rübenkopf.
- Gürtelschorf (Actinobakterien, Aphanomyces cochlioides) verursacht Einschnürungen und wulstartige Wucherungen am Rübenkörper.
Ein sicherer Nachweis von R. solani ist nur im Labor möglich (ELISA oder molekular-biologische Methoden). Unter dem Mikroskop erkennt man den Pilz an den senkrecht zueinander stehenden Hyphen.
Krankheitserreger
Rhizoctonia solani kommt weltweit in fast allen Böden vor, wobei die grössten Schäden auf schweren und feuchten Böden auftreten. Der Pilz bildet keine Sporen sondern ein charakteristisches stark verzweigtes Myzel und Sklerotien (Dauerkörper). Die Verzweigungen der Haupthyphen stehen mehr oder weniger senkrecht zueinander (Abb. 3). Nach der Verzweigung ist die neue Hyphe zunächst verengt und hat anschliessend eine Querwand (Septum). Die Hyphen sind hell- bis dunkelbraun, vielkernig und ohne Schnallen. Die Sklerotien messen 0.1 - 1 mm im Durchmesser, sind dunkelbraun und bestehen aus einem dichten Geflecht aus tonnenförmigen Zellen.
Die sexuelle (teleomorphe) Form Thanatephorus cucumeris wird auf Blattstielen gebildet und besteht aus einer Fruchtschicht mit Basidien, die Basidiosporen abschnüren.
Von Rhizoctonia solani existieren verschiedene Rassen, die in 13 verschiedene Anastomosegruppen (AG) eingeteilt werden (Tsror 2010, Strausbaugh et al. 2011). Rhizoctonia-Erreger, die eine erfolgreiche Hyphenverschmelzung durchführen können, gehören derselben Anastomosegruppe an (Miedaner et al. 2018). Je nach Zugehörigkeit zu einer AG kann R. solani unterschiedliche Kulturen befallen. Die AG 2-2 ist der Erreger der Späten Rübenfäule. Innerhalb dieser AG werden zwei Untergruppen IIIB und IV unterschieden, die sich durch einen mehr oder weniger engen Wirtspflanzenkreis auszeichnen. Die AG 2-2 IIIB ist aggressiver und befällt auch Sojabohnen, Bohnen, Mais und verschiedene Gräser. Die AG 2-2 verursacht auch eine Umfallkrankheit an Zuckerrübenkeimlingen, wobei AG 4 an den Keimpflanzen häufiger auftritt als AG 2-2.
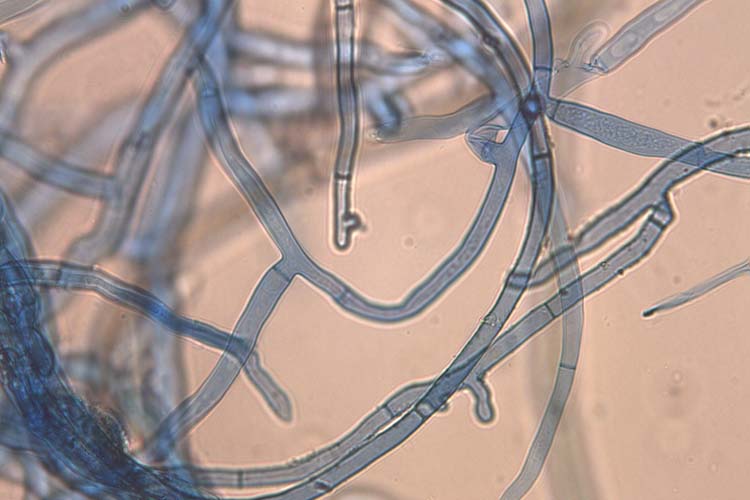 Abb. 3. Myzel von Rhizoctonia solani: Die Verzweigungen der Haupthyphen stehen senkrecht zueinander.
Abb. 3. Myzel von Rhizoctonia solani: Die Verzweigungen der Haupthyphen stehen senkrecht zueinander.
Lebenszyklus und Epidemiologie
Rhizoctonia solani überdauert als verdickte Hyphe oder als Sklerotien mehrere Jahre im Boden. Der Erreger kann auch als Saprophyt (als Myzel) auf abgestorbenem organischem Material überleben. Die Infektion der Zuckerrübe erfolgt bei Bodentemperaturen zwischen 12 und 35 °C (Harveson et al. 2009). Die Hyphen befallen die Blattstiele, den Rübenkopf und die Wurzel. Mit Hilfe von zellwandauflösender Enzyme dringen sie direkt in das Pflanzengewebe ein. Werden die Leitbahnen der Pflanze befallen, kann die Wasser- und Nährstoffversorgung unterbrochen werden, die Pflanze beginnt zu welken und stirbt ab. Gelangt während Bewirtschaftungsmassnahmen infizierter Boden auf den Rübenkopf, kann die Krankheit verstärkt auftreten.
Die Späte Rübenfäule tritt grundsätzlich in allen Böden auf. Eine schlechte Bodenstruktur und eine hohe Bodenfeuchte begünstigen jedoch das Vorkommen.
Wirtsspektrum
Die Anastomosegruppe AG 2-2 IIIB befällt neben Zuckerrüben auch Sojabohnen, Ackerbohnen, Mais und verschiedene Gräser. Die AG 2-2 IV kommt auf Zuckerrüben und verschiedenen Gräserarten vor. Kartoffeln können von AG 2-2 nicht befallen werden, sie werden hauptsächlich von der AG 3 infiziert. Wirtspflanzen der AG 4 sind Zuckerrüben (Keimlingsbefall), Tomaten, Erbsen, Kartoffeln und Sojabohnen.
Vorbeugende Massnahmen und Bekämpfung
- Fruchtfolge: Eine Anbaupause von mindestens drei Jahren einhalten! Während der Anbaupause sollten keine Wirtspflanzen von R. solani AG 2-2 angebaut werden. Der Verzicht auf Mais in der Fuchtfolge zugunsten von Getreide hat den grössten Effekt auf die Schadensminderung an Zuckerrüben (Miedaner et al. 2018). In dieser Zeit ist auch eine konsequente Unkrautbekämpfung wichtig, da R. solani AG 2-2 zahlreiche Unkrautarten befallen kann: unter anderem den weissen Gänsefuss (Chenopodium album). Infektionen über den Boden können so weitgehend verhindert werden.
- Sortenwahl: Einige Sorten sind weniger anfällig. Auf bekannten Befallsstandorten sollte eine gegen R. solani tolerante Sorte angebaut werden.
- Alle Massnahmen, die ein schnelles Wachstum der Zuckerrüben fördern: Auf eine gute Bodenstruktur achten, Bodenverdichtungen und Staunässe vermeiden und auf eine angepasste Kalk- und Humusversorgung achten
- Infizierte Erde sollte bei der Bewirtschaftung der Felder nicht auf den Rübenkopf gelangen.
- Der Einsatz von Antagonisten und Hyperparsiten (Bacillus subtilis, Verticillium biguttatum, Trichoderma harzianum etc.) als biologische Pflanzenschutzmittel können R. solani unterdrücken.
- Tiefwurzelnde Zwischenfrüchte (Ölrettich, Gelbsenf etc.) fördern die Antagonisten und verbessern die Bodenstruktur.
Literatur
Harveson RM, Hanson LE, Hein GL, 2009. Compendium of Beet Diseases and Pests. The American Phytopathological Society, Auflage 2: 140 S.
Miedaner T, Beyer W, Flath K, Hausladen H, Holtschulte B, Kessel B, Koopmann B, Schubiger FX, von Tiedemann A, Zellner M, 2018. Management von Pilzkrankheiten im Ackerbau. Agrimedia, Erling Verlag: 280 S.
Strausbaugh CA, Eujayl IA, Panella LW, Hanson LE, 2011. Virulence, distribution and diversity of Rhizoctonia solani from sugar beet in Idaho and Oregon. Can. J. Plant Pathol. 33 (2): 210-226.
Tsror L, 2010. Biology, Epidemiology and Management of Rhizoctonia solani on Potato. Journal of Phytopathology 158: 649-658.




