Silberschorf
gale argentée ou tache argentée (franz.); silver scurf (engl.)
wissenschaftlicher Name: Helminthosporium solani (Durieu & Mont.)
Taxonomie: Fungi, Ascomycota, Dothideomycetes, Pleosporomycetidae, Pleosporales, Massarinaceae
Silberschorf, verursacht durch Helminthosporium solani, ist eine Pilzkrankheit der Kartoffelknolle. Sie verschlechtert die Schalenqualität und führt zu Wasser- und Gewichtsverlusten. Befallenes Pflanzgut ist die wichtigste Infektionsquelle. Im Lager breitet sich der Pilz schnell aus.

 Abb. 1. Silberschorf (Helminthosporium solani) auf einer Kartoffelknolle
Abb. 1. Silberschorf (Helminthosporium solani) auf einer Kartoffelknolle
Krankheitsbild
Die Krankheitssymptome von Silberschorf treten an gewaschenen, erdfreien Knollen auf. Typisch sind runde, silbrig glänzende Flecken unterschiedlicher Form und Grösse auf der Knollenoberfläche (Abb. 1 und 2). Die Flecken sind scharf begrenzt und haben einen bräunlichen Rand. Innerhalb der Flecken sind Sporenträger als winzige schwarze Punkte sichtbar. Befallene Knollen neigen zu erhöhtem Wasserverlust und schrumpfen.
Unmittelbar nach der Ernte sind die Flecken meist sehr klein. Im Lager werden sie mehrere Zentimeter gross und bedecken einen beträchtlichen Teil der Knollenoberfläche.
Der Krankheitserreger dringt in die Korkschicht der Knollenschale ein und löst diese vom Zellgewebe ab. Der entstehende Hohlraum füllt sich mit Luft, was zur Bildung des silbrigen Glanzes der Schale führt (Radtke und Rieckmann 1990).
Verwechslungsmöglichkeiten: Colletotrichum coccodes verursacht ähnliche Flecken. Colletotrichum-Flecken sind dunkler, unscharf begrenzt und haben eine unregelmässige Form. Auf den Flecken sind Mikrosklerotien als kleine schwarze Punkte sichtbar. C. coccodes befällt auch Stängel und Stolonen.
Krankheitserreger
Die Konidienträger von H. solani sind septiert und nicht verzweigt, 600 µm lang und an der Basis 9-15 µm, an der Spitze 6-9 µm dick (Ellis 1971) (Abb. 3, 4 und 5). Die Konidien sind gerade oder leicht gebogen, keulenförmig, durch 2-8 Pseudosepten unterteilt, 24-85 µm lang, 7-11 µm breit und an der Basis mit einer dunklen Narbe versehen (Abb. 5). Das Myzel von H. solani ist septiert, verzweigt, hyalin und wird mit zunehmendem Alter grün bis braun.

 Abb. 3. Konidienträger mit Konidien von Helminthosporium solani auf Kartoffelknollen
Abb. 3. Konidienträger mit Konidien von Helminthosporium solani auf Kartoffelknollen
 Abb. 4. Konidienträger mit Konidien von Helminthosporium solani auf Kartoffelknollen
Abb. 4. Konidienträger mit Konidien von Helminthosporium solani auf Kartoffelknollen
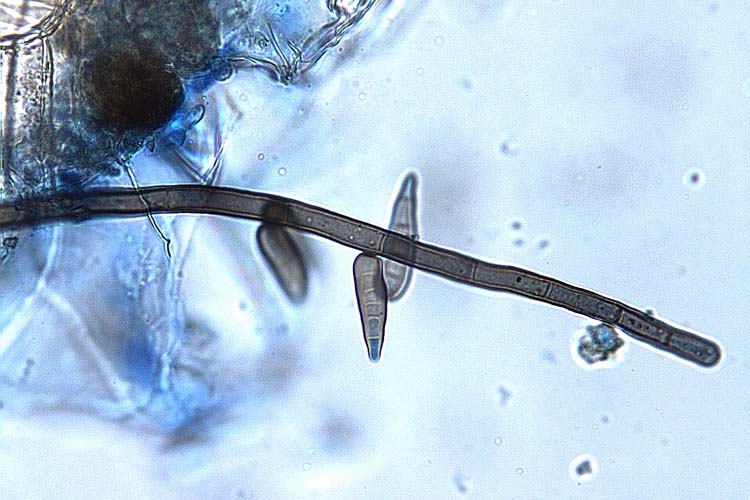
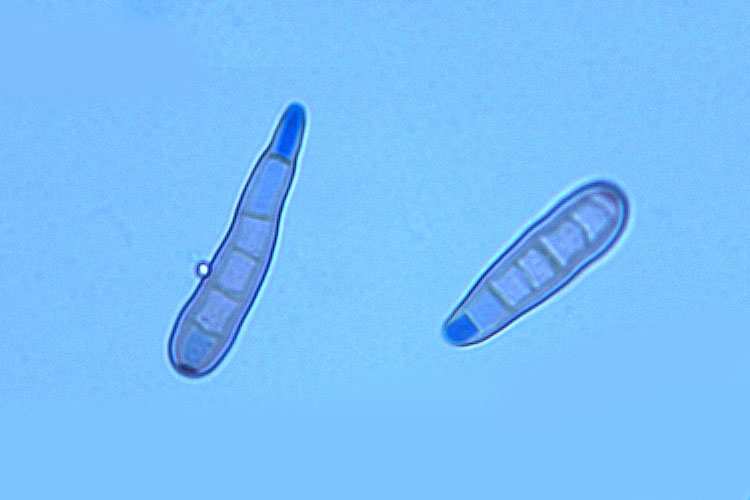 Abb. 5. Konidienträger (oben) und Konidien (unten) von Helminthosporium solani
Abb. 5. Konidienträger (oben) und Konidien (unten) von Helminthosporium solani
Bemerkungen zur Gattung Helminthosporium
Der Gattungstypus von Helminthosporium bildet die erste Konidie am Ende des Konidienträgers, weitere Konidien entstehen seitlich an den unteren Zellen. Nach der Bildung der ersten Konidie kommt es zu keinem weiteren Wachstum des Konidienträgers. Helminthosporium Arten, die auf Gräsern vorkommen, bilden hingegen die Konidien immer nur an der Spitze des Konidienträgers. Sobald die erste Konidie ihre Entwicklung ganz oder teilweise abgeschlossen hat, bildet die oberste Zelle des Trägers einen seitlichen Fortsatz, an dessen Ende erneut eine Konidie entsteht. Hughes (1953 und 1958) schloss deshalb die an Gräsern wachsenden Arten aus der Gattung Helminthosporium aus und Shoemaker (1959 und 1962) fasste diese Gruppe der Blattfleckenerreger in den Gattungen Drechslera und Bipolaris zusammen: Arten mit zylindrischen Konidien, welche von jeder Zelle mit einem seitlichen Keimschlauch auskeimen, wurden der Gattung Drechslera zugeordnet. Alle Arten mit spindelförmigen Konidien, die nur aus den Endzellen unter Ausbildung eines polaren Keimschlauches auskeimen, wurden der Gattung Bipolaris zugeordnet.
Lebenszyklus und Epidemiologie
Pflanzgut ist häufig mit Silberschorf (H. solani) befallen. Der Erreger gelangt auf diese Weise in den Boden. Auf den befallenen Pflanzkartoffeln bildet er Konidien, die über das Bodenwasser zu den Tochterknollen gelangen und diese infizieren. Der Erreger kann auch im Boden überwintern und dort bis zu 9 Monate lebensfähig bleiben (Radtke und Rieckmann 1990). Es konnte gezeigt werden, dass Kartoffelknollen auch über dieses bodenbürtige Inokulum infiziert werden können (Stevenson et al. 2001).
Die Infektion der Knollen erfolgt über die Lentizellen oder direkt durch die Kartoffelschale (Periderm). Der Pilz kann sowohl unreife als auch reife Knollen befallen. Das Myzel entwickelt sich ausschliesslich in der äussersten verkorkten Schalenschicht. Solange sich die Knollen noch im Boden liegen, breitet sich der Befall auf der Knollenoberfläche nur langsam aus. Eine hohe Bodenfeuchtigkeit kann die Entwicklung beschleunigen. Zum Zeitpunkt der Ernte sind die Knollen häufig mit Silberschorf befallen, meist ist der Befall unauffällig und kaum sichtbar. Die Infektion wird erst im Lager gut sichtbar, wo günstige Bedingungen für das Myzelwachstum, die Konidienbildung, die Ausbreitung der Konidien sowie für Neuinfektionen herrschen. H. solani wächst zwischen 3 und 30 °C (Optimum 20-24 °C) (Radtke und Rieckmann 1990), daher führen hohe Lagertemperaturen in Verbindung mit hoher Luftfeuchtigkeit zu verstärktem Knollenbefall.
Wirtsspektrum
Helminthosporium solani befällt nur dieKnollen der Kartoffel (Solanum tuberosum). Der Pilz überlebt aber auch als Saprophyt im Boden.
Vorbeugende Massnahmen und Bekämpfung
- Eine weite Fruchtfolge einhalten, keine Kartoffeln nach Kartoffeln.
- Durchwuchskartoffeln konsequente bekämpfen
- Staunässe vermeiden und für eine optimale Wasserversorgung sorgen
- Gesundes Pflanzgut verwenden: Mit Silberschorf befallene Knollen sind die wichtigste Infektionsquelle!
- Sortenunterschiede beachten: Feinschalige Speise-Lagersorten sind anfälliger und benötigen eine besondere Aufmerksamkeit bezüglich Silberschorf (Pflanzgutbeizung wird empfohlen). Siehe auch Schweizer Sortenliste für Kartoffeln.
- Schalenfeste Knollen möglichst früh ernten und sofort trocknen: Erdfreie Knollen für 2 bis 3 Wochen bei 12 bis 15 °C zur Wundheilung lagern. Anschliessend Temperatur kontinuierlich absenken auf 3 bis 4 °C bei weniger als 90 % relativer Luftfeuchtigkeit (Kühllager) (Kühne et al. 2008).
- Im Kühllager: Temperaturschwankungen vermeiden (zur Vermeidung der Bildung von Kondenswasser) sowie für eine gute Luftzirkulation sorgen (um Luftfeuchtigkeit zu senken)
- Saubere Lagerräume, ev. mit Desinfektionsmittel behandeln
- Bei empfindlichen Sorten wird eine Behandlung des Pflanzgutes mit einem zugelassenen Pflanzenschutzmittel empfohlen. Proradix und Deposan sind zwei neue biologische Beizmittel gegen Silberschorf. Beide Produkte enthalten das Bodenbakterium Pseudomonas spp. Proradix wird vor der Pflanzung, Deposan vor dem Einlagern auf die Knollen gespritzt. Auch im biologischen Landbau in der Schweiz zugelassen (Betriebsmittelliste).
- Empfohlene und zugelassene Pflanzenschutzmittel gegen den Silberschorf finden Sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit).
Literatur
Ellis M.B. 1971. Dematiaceous Hyphomycetes. Commenwealth Mycological Institute Kew, Surrey England: 608 p.
Hughes SJ, 1953. Conidiophores, conidia, and Classification. Canadian Journal of Botany 31, 577—659.
Hughes SJ, 1958. Revisiones hyphomycetum aliquot cum appendice de nomimbus rejiciendis. Canadian Journal of Botany 36, 727—836.
Kühne S, Burth U, Marx P, 2006. Biologischer Pflanzenschutz im Freiland. Eugen Ulmer KG, Stuttgart: 288 S.
Radtke W, Rieckmann W, 1990. Krankheiten und Schädlinge der Kartoffel. Verlag Th. Mann, Gelsenkirchen-Buer, 167 S.
Shoemaker RA, 1959. Nomenclature of Drechslera and Bipolaris, grass parasites segregated from “Helminthosporium”. Canadian Journal of Botany 37: 879-887.
Shoemaker RA, 1962. Drechslera Ito. Canadian Journal of Botany 40: 809-836.
Stevenson WR, Loria R, Franc GD, WeingartnerDP, 2001. Compendium of Potato Diseases, second edition. The American Phytopathological Society, St. Paul: 106 S.




