Echter Mehltau des Rotklees
oïdium des trèfles (fr.), powdery mildew (engl.)
Wissenschaftlicher Name: Microsphaera trifolii (Grev.) U. Braun
Synonyme: Erysiphe trifolii Grev., E. polygoni DC. Em. Salm., E. martii Lév.
Taxonomie: Fungi, Ascomycota, Leotiomycetes, Leotiomycetidae, Erysiphales, Erysiphaceae
Microsphaera trifolii, der Echte Mehltau des Rotklees (Trifolium pratense), bildet an der Blattoberseite einen dichten weiss-grauen Myzelbelag. Die Krankheit kommt in Regionen mit gemässigtem Klima häufig vor. Ein Befall kann den Futterertrag senken und die Qualität mindern.



 Abb. 1. Echter Mehltau (Microsphaera trifolii) an Rotklee (Trifolium pratense)
Abb. 1. Echter Mehltau (Microsphaera trifolii) an Rotklee (Trifolium pratense)
Schadbild
Der echte Mehltau verursacht äusserst auffallende Symptome vorwiegend an der Blattoberseite: Eine befallene Pflanze sieht wie mit Mehl bestäubt aus (Abb. 1). Der Belag besteht aus Konidien bildendem Myzel (Abb. 2) und kann grosse Teile des Blattes bedecken. Später entstehen in den grau-weissen Myzelpolstern kleine schwarze Punkte, die Kleistothecien (Abb. 5 und 6). Sind die Blätter vollständig mit Myzel belegt, werden sie gelb, dann braun, welken und vertrocknen.
Krankheitserreger
Die Konidien des echten Mehltaus sind hyalin, einzellig und haben die Form eines Weinfasses (Abb. 3 und 4). Sie werden an Konidienträgern gebildet und messen 25-40 x 16-22 µm (O'Rourke, 1976). Bei M. trifolii werden die Konidien meistens vom Träger abgestossen bevor eine neue Spore heranreift, so dass jeweils nur eine Konidie pro Konidienträger beobachtet werden kann. Im Herbst entsteht in älteren Myzelien die Hauptfruchtform: Kleistothecien mit Asci und Ascosporen (Abb. 5 und 6). Die Kleistothecien (Durchmesser 90-125 µm) sind dunkelbraun, rund und mit charakteristischen Anhängseln versehen (O'Rourke, 1976). In den Fruchtkörpern befinden sich 5-10 eiförmige Asci (50-80 x 25-40 µm). Jeder Ascus enthält 3-4 (selten 6) Ascosporen, die 20-25 x 10-15 µm messen.
Zwischen den echten und falschen Mehltaupilzen besteht ein grundsätzlicher Unterschied: Der echte Mehltau wächst hauptsächlich als Myzel an der Blattoberseite, der falsche Mehltau bildet die sichtbaren Sporangien an der Blattunterseite.
 Abb. 2. Echter Mehltau (Microsphaera trifolii) des Rotklees: Konidien auf Konidienträgern
Abb. 2. Echter Mehltau (Microsphaera trifolii) des Rotklees: Konidien auf Konidienträgern
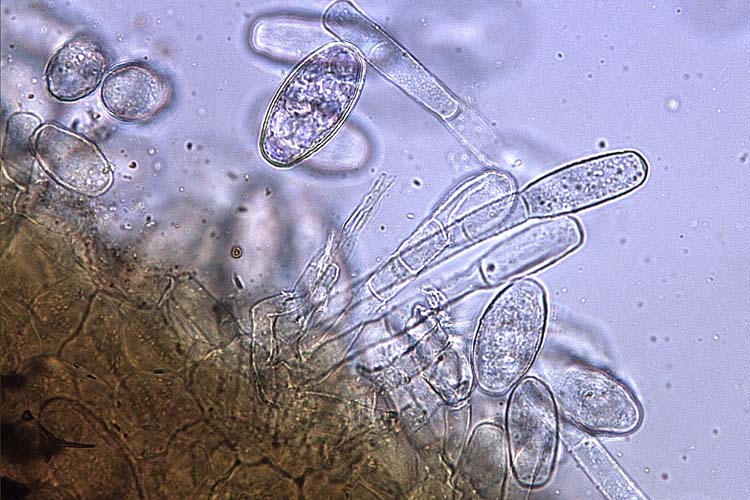 Abb. 3. Echter Mehltau (M. trifolii) des Rotklees: Konidien auf Konidienträgern
Abb. 3. Echter Mehltau (M. trifolii) des Rotklees: Konidien auf Konidienträgern
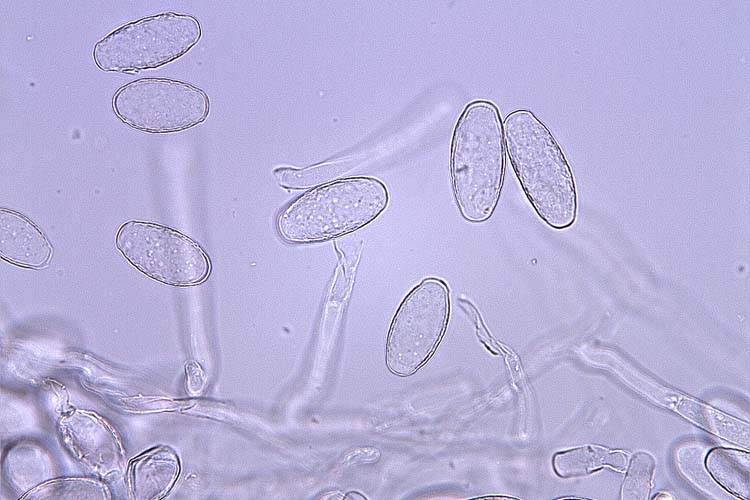 Abb. 4. Konidien der M. trifolii (echter Mehltau des Rotklees)
Abb. 4. Konidien der M. trifolii (echter Mehltau des Rotklees)
 Abb. 5. Der echte Mehltau wächst an der Blattoberseite. Im Herbst entstehen Kleistothecien, die als kleine schwarze Punkte sichtbar sind.
Abb. 5. Der echte Mehltau wächst an der Blattoberseite. Im Herbst entstehen Kleistothecien, die als kleine schwarze Punkte sichtbar sind.
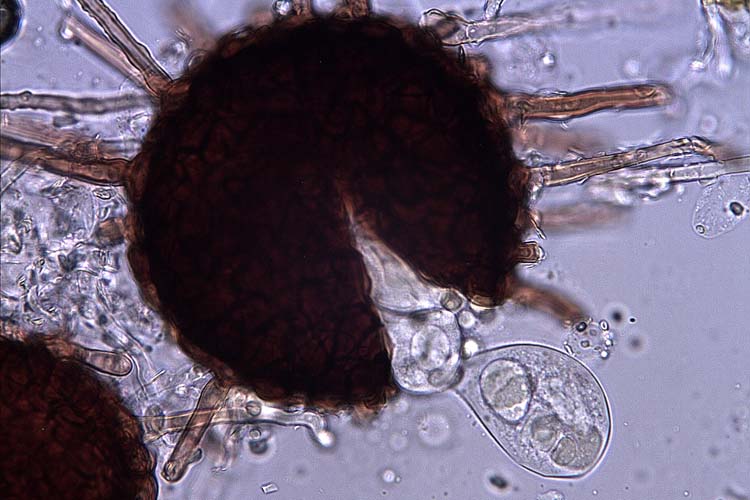 Abb. 6. Kleistothecium von M. trifolii: Die sackförmigen Gebilde, die aus dem Kleistothecium herausgedrückt werden, sind Asci mit Ascosporen.
Abb. 6. Kleistothecium von M. trifolii: Die sackförmigen Gebilde, die aus dem Kleistothecium herausgedrückt werden, sind Asci mit Ascosporen.
Lebenszyklus und Epidemiologie
M. trifolii, der echte Mehltau des Rotklees, überzieht die Blattoberseite mit einem dichten, aus Pilzhyphen bestehendem Myzel. An jungen Hyphen bilden sich Appressorien (Haftorgane) aus denen Penetrationshyphen durch Kutikula und Epidermiszellwand des Blattes dringen. Im Inneren der Epidermiszelle bildet der Parasit Haustorien (Saugorgane) über die die Nahrungsaufnahme erfolgt. Der echte Mehltau ist ein obligat biotropher Ektoparasit und lässt sich nicht auf künstlichen Nährmedien kultivieren.
Aus dem oberflächlich wachsenden Mycel entwickeln sich Konidienträger, auf denen Konidien entstehen. Die Konidien sorgen für die Massenvermehrung während der Vegetationsperiode. Schönes, trockenes und warmes Wetter begünstigt eine Krankheitsepidemie. Konidien haben einen hohen Wassergehalt. Sie können deshalb auch unter verhältnismässig trockenen Umweltverhältnissen keimen, freies Wasser kann die Bildung und Keimung der Konidien sogar hemmen. Deshalb kann häufiger Regen die Krankheit unterdrücken. Stavely und Hanson (1966b) fanden, dass eine Temperatur von 24 °C optimal für die Konidienkeimung, Myzelwachstum und Sporulation ist.
Am Ende der Vegetationsperiode entstehen Fruchtkörper (Kleistothecien) mit den Asci und den Ascosporen. Bei Benetzung öffnen sich die Fruchtkörper und die Asci schleudern die Ascosporen bis 2 cm in den Luftstrom.
Der Parasit kann als ruhendes Myzel in befallenen Pflanzen überwintern. Das Vorhandensein von Kleistothecien scheint für die Überwinterung des Parasiten nicht entscheidend zu sein. Letztere sind aber wichtig für die genetische Rekombination und für die Bildung neuer Rassen.
Wirtsspektrum
Der echte Mehltau ist eine häufig auftretende und wichtige Krankheit des Rotklees. Dieser Parasit besteht aus verschiedenen physiologischen Rassen, welche Rotkleesorten unterschiedlich stark befallen können. In den USA konnten zum Beispiel Stavely und Hanson (1966a) auf sechs Klonen von Rotklee 12 verschiedene Rassen unterscheiden.
M. trifolii befällt auch andere Leguminosenarten (Trifolium sp., Lathyrus sp., Onobrychis sp.). Der echte Mehltau auf Luzerne ist eine eigenständige Art, die Erysiphe pisi.
Vorbeugende Bekämpfungsmassnahmen
Die Züchtung von resistenten Sorten ist möglich. Stavely und Hanson zeigten dies bereits 1967. In der Zwischenzeit sind die meisten, der für den Anbau in der Schweiz empfohlenen Sorten mehr oder weniger resistent. Ein allfälliger Schaden kann deshalb durch die Aussaat von empfohlenen Sorten verhindert werden (Liste der empfohlenenSorten von Futterpflanzen, Schweiz). Auch ein rechtzeitiger Schnitt kann eine Epidemie unterdrücken.
Literatur
O'Rourke CJ, 1976. Diseases of grasses and forage legumes in Ireland. An Foras Taluntais, Dublin 4. 115 S.
Stavely JR und Hanson EW, 1966a. Identification and maintenance of races of Erysiphe polygoni from Trifolium pratense. Phytopathology 56: 795-798.
Stavely JR und Hanson EW, 1966b. Some effects of temperature and relative humidity on development of Erysiphe polygoni on Trifolium pratense. Phytopathology 56: 940-943.
Stavely JR und Hanson EW, 1967. Genetics of resistance to Erysiphe polygoni in Trifolium pratense. Phytopathology 57: 193-197.




