Rhizoctonia-, Wurzeltöterkrankheit oder Weisshosigkeit
Rhizoctone (franz.); Rhizoctonia canker and black scurf (engl.)
wissenschaftlicher Name: Rhizoctonia solani J.G. Kühn (anamorph), Thanatephorus cucumeris (A.B. Frank) Donk (teleomorph)
Taxonomie: Fungi, Basidiomycota, Agaricomycotina, Agaricomycetes, Cantharellales, Ceratobasidiaceae
Der Pilz Rhizoctonia solani befällt die Kartoffelpflanze über den Boden oder über das Pflanzgut. Er verursacht Ertragsverluste (Auflaufschäden, Nekrosen an Stängeln und Stolonen, viele kleine oder unförmige Knollen) sowie Qualitätsverluste (Kartoffelpocken, «Dry-core» Symptome). Eine drei- bis vierjährige Anbaupause zwischen zwei Kartoffelkulturen und die Verwendung von gesundem Pflanzgut sind die wichtigsten vorbeugenden Massnahmen gegen einen Befall mit Rhizoctonia.
 Abb. 1. Kartoffelpocken (Sklerotien) der Wurzeltöterkrankheit (Rhizoctonia solani) an Kartoffelknollen
Abb. 1. Kartoffelpocken (Sklerotien) der Wurzeltöterkrankheit (Rhizoctonia solani) an Kartoffelknollen
Krankheitsbild
Die Rhizoctonia-Krankheit, auch Wurzeltöterkrankheit oder Weisshosigkeit genannt, verursacht verschiedene Symptome (Häni et al. 2008):
Kartoffelpocken: Die auffälligsten Anzeichen eines Befalls sind dunkelbraune bis schwarze, unregelmässig geformte Sklerotien auf der Knollenoberfläche (Abb. 1 und 4). Diese sogenannten Kartoffelpocken dringen nicht in die Knolle ein und lassen sich leicht von der Schale abkratzen, aber nicht abwaschen.
Auflaufschäden: Befallenes Pflanzgut oder eine Verseuchung des Bodens mit Rhizoctonia kann zu einem unregelmässigen, verspäteten Auflaufen oder zu Fehlstellen führen. Die unterirdischen Keime und Stolonen zeigen an verschiedenen Stellen braune bis schwarze Flecken, die oft leicht eingesunken sind und die betroffenen Organe einschnüren. Die Triebspitzen sterben häufig ab. Neu gebildete Keime werden ebenfalls befallen. Als Folge entsteht eine Lücke im Pflanzenbestand oder es erreichen nur noch wenige schwache Triebe die Bodenoberfläche.
Kleine, unförmige Knollen: Ein starker Befall der Stolonen führt zu vielen kleinen Knollen und zu Knollen mit Missbildungen und Wachstumsrissen.
«Dry-Core» Symptome: Pilzhyphen von Rhizoctonia wachsen über die Lentizellen in die Knollen ein und verursachen das «Dry core» Symptom (Abb. 2): Auf der Kartoffelschale erscheinen rundliche, leicht eingesunkene, scharf begrenzte, bräunliche Flecken von 3 bis 6 mm Durchmesser (Abb. 2). Das darunter liegende Gewebe ist bis zu einer Tiefe von 10 mm zerstört und scharf gegen das gesunde Gewebe abgegrenzt. Der zerstörte Gewebepfropfen kann herausfallen, so dass das Krankheitsbild leicht mit einem Schorfbefall oder Drahtwurmbefall verwechselt werden kann. Im Gegensatz zu diesen bleibt jedoch die Knollenschale als Häutchen am Lochrand erhalten (Radtke und Rieckmann 1990).
Wipfelrollen und Luftknollen: Befallene Pflanzen zeigen während der Vegetation häufig das sogenannte «Wipfelrollen»: Die Fiederblätter an der Triebspitze falten sich der Länge nach zusammen, werden heller und verfärben sich je nach Sorte rotviolett (Radtke und Rieckmann 1990). Bei starkem Befall kann es zur Bildung von Luftknollen kommen (Achtung: Luftknollen können auch andere Ursachen haben).
Weisshosigkeit: Bei feuchter Witterung und dichtem Pflanzenbestand kann die Stängelbasis mit einem grauweissen Belag (Pilzmyzel) überzogen sein. Dieses Schadbild wird als „Weisshosigkeit“ bezeichnet. Auf dem Myzel bilden sich Basidien mit Basidiosporen. Es handelt sich hier um das sexuelle Stadium des Krankheitserregers (= Hauptfruchtform Thanatephorus cucumeris).

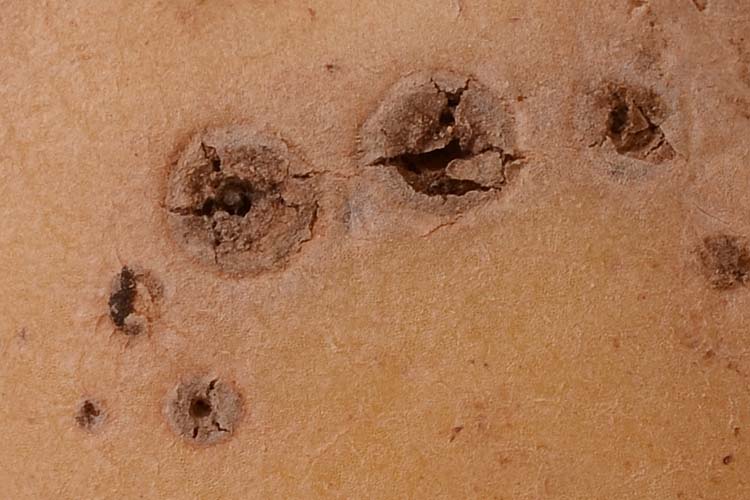
 Abb. 2. «Dry-core» Symptome der Wurzeltöterkrankheit (Rhizoctonia solani) an einer Kartoffelknolle (unten:aufgeschnittene Knolle)
Abb. 2. «Dry-core» Symptome der Wurzeltöterkrankheit (Rhizoctonia solani) an einer Kartoffelknolle (unten:aufgeschnittene Knolle)
Krankheitserreger
Rhizoctonia solani bildet ein stark verzweigtes Myzel und Sklerotien (Dauerkörper), aber keine Konidien. Die Verzweigungen der Haupthyphen stehen meist mehr oder weniger senkrecht zueinander (Abb. 3). Nach der Verzweigung ist die neue Hyphe zunächst verengt und hat dann eine Querwand (Septum). Die Hyphen haben keine Schnallen. Der Durchmesser der Haupthyphe von R. solani beträgt 8-10 µm (Stevenson et al. 2001). Junge vegetative Hyphen von R. solani sind anfangs weiss, später bräunlich. Sie sind vielkernig.
Die Sklerotien der R. solani messen je nach Isolat 0.1 bis 10 mm im Durchmesser. Sie haben eine unregelmässige Form, sind dunkelbraun bis schwarz und bestehen aus einem dichten Geflecht von Pilzhyphen (Abb. 4).
Die sexuelle Form (Teleomorphe) Thanatephorus cucumeris wird auf Hyphen aus dickwandigen Zellen gebildet und besteht aus Basidien, welche Basidiosporen abschnüren. Die sexuelle Form wird selten gebildet und ihre Bedeutung für den Lebenszyklus ist weitgehend unbekannt.
R. solani wird in 13 verschiedene Anastomosegruppen (AG) unterteilt (Tsror 2010). Innerhalb einer AG können die Hyphen miteinander verschmelzen. Je nach Zugehörigkeit zu einer AG kann R. solani unterschiedliche Kulturen befallen. Die AG-3 tritt bei Kartoffeln mit Abstand am häufigsten auf. Sie ist relativ wirtsspezifisch. Sklerotien an Kartoffelknollen gehören fast ausschliesslich zu dieser Anastomosegruppe. Die AG-2-1, AG-4, AG-5, AG-8 und AG-9 können ebenfalls Kartoffeln befallen, verursachen aber nur geringe Schäden.
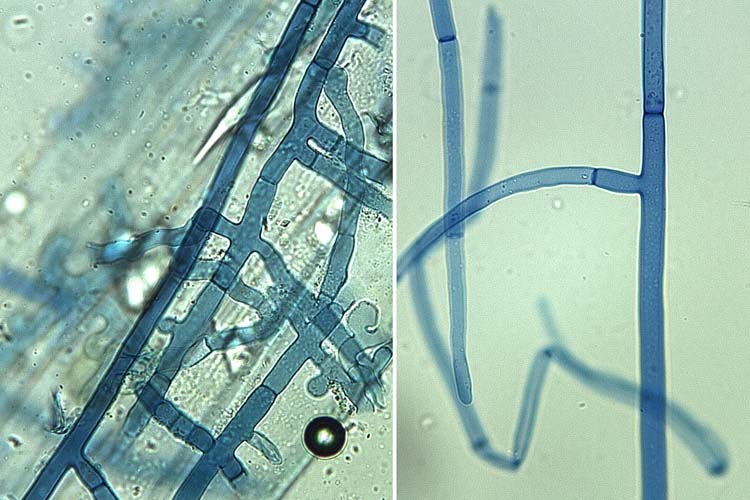 Abb. 3. Rhizoctonia Arten bilden ein stark verzweigtes Myzel. Die Verzweigungen der Haupthyphen stehen rechtwinklig zueinander.
Abb. 3. Rhizoctonia Arten bilden ein stark verzweigtes Myzel. Die Verzweigungen der Haupthyphen stehen rechtwinklig zueinander.
 Abb. 4. Kartoffelpocken (Rhizoctonia solani) vergrössert
Abb. 4. Kartoffelpocken (Rhizoctonia solani) vergrössert
Lebenszyklus und Epidemiologie
Die Rhizoctonia-Krankheit wird hauptsächlich durch die an den Pflanzkartoffeln anhaftenden Sklerotien verursacht. Der Krankheitserreger kann aber auch auf abgestorbenen Pflanzenresten im Boden (als Saprophyt) mehrere Jahre überdauern, so dass eine Primärinfektion der Kartoffelpflanzen auch über einen Bodenbefall erfolgen kann. In Betrieben mit einer vielfältigen Fruchtfolge und Anbaupausen von mindestens vier Jahren ist die Bodeninfektion jedoch von untergeordneter Bedeutung. Die Hauptinfektionsquelle ist befallenes Pflanzgut (Keiser und Flückiger 2013).
Aus den Sklerotien wachsen Pilzhyphen, welche in die jungen Keime eindringen und die oben beschriebenen Krankheitssymptome hervorrufen. Grüne, nicht verletzte Keime können nicht befallen werden.
Hohe Temperaturen während der frühen Wachstumsphase vermindern mögliche Schäden durch Rhizoctonia. Niedrige Temperaturen zu Beginn der Kartoffelsaison fördern diese.
Während des Wachstums scheiden die neu gebildeten Knollen flüchtige Stoffe aus, welche die Bildung von Sklerotien verhindern. Mit zunehmender Reife der Knollen, insbesonders nach der Krautvernichtung, nimmt diese Hemmung ab. Je länger die Kartoffelknollen nach der Abreife im Boden verbleiben, desto zahlreicher und grösser werden die Sklerotien auf der Knollenoberfläche.
Der Krankheitserreger überdauert als Sklerotien an den Knollen (Kartoffelpocken) und kann mit dem Pflanzgut über weite Strecken übertragen werden.
Wirtsspektrum
Die Anastomosegruppe 3 (AG-3) ist mit Abstand die häufigste Untergruppe von R. solani an Kartoffeln. AG-3 ist wirtsspezifisch und befällt fast ausschliesslich Kartoffeln (Stevenson et al. 2001). Von den 13 beschriebenen Anastomosegruppen der R. solani können AG-2-1, AG-4, AG-5, AG-8 und AG-9 ebenfalls Kartoffel befallen, verursachen aber nur geringe Schäden.
Vorbeugende Massnahmen und Bekämpfung
- Eine Anbaupause von drei bis vier Jahren einhalten! Bodeninfektionen können dadurch weitgehend vermieden werden.
- Verwendung von gesundem zertifiziertem Pflanzgut: Weniger als 20 % der Knollen sollten mit Kartoffelpocken (Sklerotien) befallen sein (100 Knollen prüfen). (Agridea, Datenblätter Ackerbau)
- Alle Massnahmen, die ein schnelles Auflaufen der Kartoffeln fördern: Pflanzgut vorkeimen, in erwärmten, gut vorbereiteten Boden pflanzen (bei vorgekeimten Knollen ab Bodentemperaturen von 5 bis 6 °C), Knollen nicht zu tief legen und spät anhäufeln.
- Sorten mit geringer Anfälligkeit anbauen (Schweizer Sortenliste für Kartoffeln).
- Nach dem Erreichen der Schalenfestigkeit, circa drei Wochen nach dem Absterben des Krautes, die Kartoffeln ernten und das Erntegut rasch trocknen.
- Organische Düngung: Auf eine gute Durchmischung der Gründüngung und der organischen Düngung mit dem Boden achten, damit das organische Material von den Bodenmikroorganismen rasch umgesetzt werden kann. Nur relativ stroharme organische Dünger verwenden.
- Der Einsatz von Antagonisten und Hyperparasiten (Bacillus subtilis, Verticillium biguttatum, Trichoderma harzianum etc.) als biologische Pflanzenschutzmittel wurde weltweit getestet (Kühne et al. 2006). Die Resultate variieren sehr stark.
- Im biologischen Landbau ist in der Schweiz Proradix zugelassen. Proradix ist ein biologisches Beizmittel (mit Teilwirkung) gegen Netz- und Silberschorf sowie Rhizoctonia. Es enthält das Bodenbakterium Pseudomonas spp. und wird vor der Pflanzung auf die Knollen gespritzt. Siehe auch Betriebsmittelliste für den biologischen Landbau in der Schweiz.).
- Beizung des Pflanzgutes mit einem bewilligten Pflanzenschutzmittel (Tauchbeizmitel oder Anwendung im Sprühverfahren): Beim maschinellen Legen der Kartoffeln können z.B. die herabfallenden Knollen mit einem Beizmittel besprüht werden (Flüssigbeizung mit Monceren). Die Wirkung dieses Verfahrens ist oft unzureichend, insbesonder wenn ein hohes Infektionspotenzial im Boden vorhanden ist. Die seit 2012 in Deutschland bewilligte Furchenbehandlung mit Ortiva (Wirkstoff Azoxystrobin) kann die Wirkung verbessern. Bei diesem Verfahren darf die Knolle nicht mit der Spritzbrühe in Kontakt kommen (schlechte Pflanzenverträglichkeit).
- Empfohlene und zugelassene Pflanzenschutzmittel gegen Rhizoctonia solani (Wurzeltöterkrankheit) finden Sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit).
Literatur
Agridea, 2021. Datenblätter Ackerbau. AGRIDEA, CH-8315 Lindau (Datenblätter Ackerbau)
Häni FJ, Popow G, Reinhard H, Schwarz A und Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Keiser A, Flückiger R, 2013. Rhizoctonia solani, ausreichende Anbaupausen und befallsfreies Pflanzgut sind entscheidend! Kartoffelbau 6: 26-30.
Kühne S, Burth U, Marx P, 2006. Biologischer Pflanzenschutz im Freiland. Eugen Ulmer KG, Stuttgart: 288 S.
Radtke W, Rieckmann W, 1990. Krankheiten und Schädlinge der Kartoffel. Verlag Th. Mann, Gelsenkirchen-Buer, 167 S.
Stevenson WR, Loria R, Franc GD, WeingartnerDP, 2001. Compendium of Potato Diseases, second edition. The American Phytopathological Society, St. Paul: 106 S.
Tsror L, 2010. Biology, Epidemiology and Management of Rhizoctonia solani on Potato. Journal of Phytopathology 158: 649-658.




