Echter Mehltau der Gräser
oïdium des graminées (fr.), powdery mildew (engl.)
Wissenschaftlicher Name: Blumeria graminis (DC.) Speer
Synonyme: Erysiphe graminis DC., Oidium monilioides (Nees) Link.
Taxonomie: Fungi, Ascomycota, Leotiomycetes, Leotiomycetidae, Erysiphales, Erysiphaceae
Der echte Mehltau der Gräser (Blumeria graminis) befällt ausser Getreidearten auch viele Wild- und Futtergräser. B. graminis besteht aus mindestens acht verschiedenen Spezialformen (formae speciales = f. sp.), welche nur bestimmten Wirtspflanzen parasitieren: Der Echte Mehltau an Raigras kann zum Beispiel die Wiesenrispe nicht befallen. Die acht Spezialformen enthalten wiederum viele verschiedene Rassen, welche nur bestimmte Sorten von einer oder wenigen Pflanzenarten befallen können.
B. graminis ist ein obligat biotropher Parasit und kann deshalb nur auf lebendem grünem Pflanzengewebe wachsen. Dabei bildet er an Blättern und Halmen ein weisses, flauschiges Pilzgeflecht. Der Anbau von resistenten Sorten ist die einfachste und sicherste Bekämpfungsmassnahme. Neu gezüchtete Sorten der Futtergräser sind meistens resistent. Dies war früher anders. D. Schmidt berichtete 1976, dass Knaulgras (Dactylis glomerata) im Allgemeinen sehr stark vom echten Mehltau befallen wird.
 Abb. 1: Echter Mehltau der Gräser (Blumeria graminis) an Wiesenrispe (Poa pratensis)
Abb. 1: Echter Mehltau der Gräser (Blumeria graminis) an Wiesenrispe (Poa pratensis)

 Abb. 2: Echter Mehltau der Gräser (Blumeria graminis) an Knaulgras (Dactylis glomerata)
Abb. 2: Echter Mehltau der Gräser (Blumeria graminis) an Knaulgras (Dactylis glomerata)
Schadbild
Erste Anzeichen eines Mehltaubefalls sind weisse, watteartige Polster vorwiegend an der Oberseite von jungen Blättern (Abb. 1 - 2), an den Blattscheiden und Halmen. Die Polster wachsen schnell und entwickeln sich zu einem mehligen Belag. Gegen Ende der Vegetation sind, eingebettet in den älteren jetzt graubraunen Mehltaubelägen, kleine schwarze Punkte sichtbar. Dies sind Kleistothecien, die (sexuell gebildete) Hauptfruchtform des Mehltaupilzes.
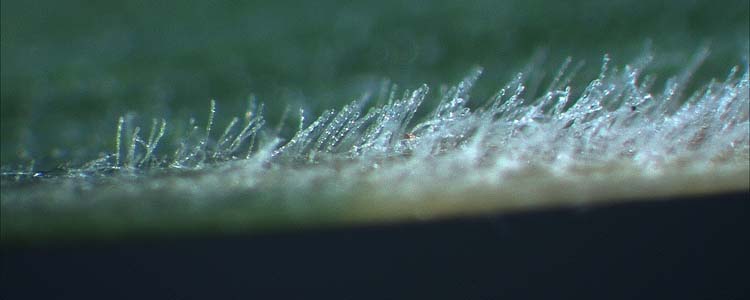 Abb. 3: Echter Mehltau der Gräser (Blumeria graminis): Konidien sind in langen Ketten angeordnet
Abb. 3: Echter Mehltau der Gräser (Blumeria graminis): Konidien sind in langen Ketten angeordnet
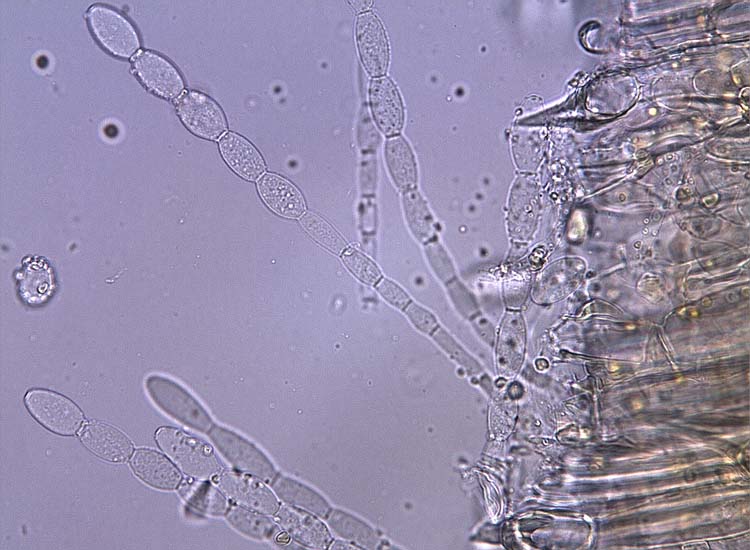 Abb. 4: Echter Mehltau der Gräser (Blumeria graminis): Konidienträger mit ellipsenförmigen Konidien, die zunächst in mehr oder weniger langen Ketten zusammenhängen.
Abb. 4: Echter Mehltau der Gräser (Blumeria graminis): Konidienträger mit ellipsenförmigen Konidien, die zunächst in mehr oder weniger langen Ketten zusammenhängen.
Krankheitserreger
Der Mehltaubelag besteht aus ineinander verfilzten, septierten Hyphen. An diesen werden auf kurzen Konidienträgern ellipsenförmige Konidien produziert, die zunächst in mehr oder weniger langen Ketten zusammenhängen (Abb. 3 und 4). Die Grösse der Konidien ist sehr variabel: 14-17 x 25-33 µm.
B. graminis ist ein heterothallischer Pilz, das heisst die Hyphen gehören zwei unterschiedlichen Paarungstypen an. Vor der Entstehung der Hauptfruchtform umschlingen sich zwei Hyphen von je einem Paarungstyp, verzweigen sich und bilden einen dichten Knäuel, die Fruchtkörperanlage. Daraus entstehen die hellbraunen bis schwarzen Kleistothecien, die sexuelle Form des Mehltaupilzes (Abb. 5). Kleistothecien sind kugelige Gebilde mit einem Durchmesser von 135 - 250 µm (Blumer, 1967), ohne natürliche Öffnung (das griechische Wort „kleistos" heisst geschlossen) und mit myzelartigen Anhängseln. Im Innern der Fruchtkörper befinden sich 8 bis 25 Asci mit je acht Acosporen. Die einzelligen Ascosporen sind ebenfalls ellipsenförmig und 10-14 x 20-24 µm gross. Sehr oft reifen die Ascosporen nicht aus.
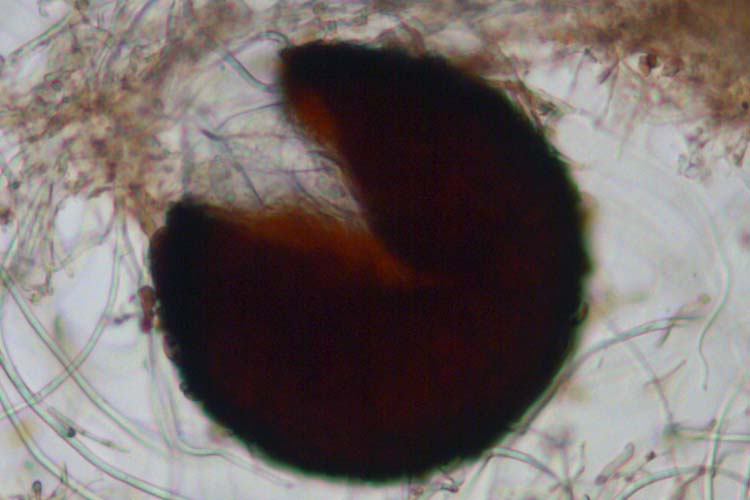 Abb. 5. Kleistothecium des echten Mehltaus der Gräser (Blumeria graminis)
Abb. 5. Kleistothecium des echten Mehltaus der Gräser (Blumeria graminis)
Lebenszyklus
Konidien und Ascosporen werden vom Wind auf benachbarte Pflanzen übertragen. Gelangen die Pilzsporen auf eine Wirtspflanze keimen sie mit einem oder mehreren Keimschläuchen und bilden Haftorgane (Appressorien) an den Blättern. Konidien der echten Mehltaupilze keimen auch bei niedriger Luftfeuchtigkeit und über einen weiten Temperaturbereich von 1-30 °C. Freies Wasser auf der Blattoberfläche hemmt die Keimung der Konidien, ja bewirkt in einigen Fällen sogar deren Absterben, da im Wasser der Gasaustausch unterbunden wird (Schönbeck, 1979). Für die Entwicklung der Keimschläuche und der Appressorien ist jedoch eine hohe Luftfeuchtigkeit erforderlich.
Unmittelbar unter dem Appressorium dringt eine Infektionshyphe durch die Kutikula und die Epidermiszellwand ins Innere der Epidermiszelle ein. Hier bildet der Pilz ein Haustorium, welches ihm zur Nahrungsaufnahme dient (Abb. 6). Die Epidermiszelle bleibt dabei noch eine kurze Zeit am Leben. Der Pilz wächst als eng verzweigtes Myzel an der Blattoberfläche weiter, bildet weitere Appressorien und Haustorien in neuen Epidermiszellen. Das Myzel benötigt für das weitere Wachstum keinen Wasserfilm an der Blattoberfläche.
Neue Konidien werden bei günstigen Umweltverhältnissen nach etwa sieben Tagen und in sehr grosser Zahl gebildet: Blumer (1967) zählte 5'000 bis 6'000 Konidien pro mm2. Konidien leben nur wenige Tage, bei 20 bis 25 °C sogar nur einige Stunden. Damit gehören die Konidien der echten Mehltaupilze im Sommer zu den kurzlebigsten Konidien von Pilzkrankheiten (Mühle, 1971).
Wenn die Blätter vom Mehltaupilz stark geschädigt und bereits am Absterben sind, beginnt der Pilz die Hauptfruchtform, sogenannte Kleistothecien, zu bilden. Diese helfen dem Pathogen, die heisse Jahreszeit ohne Wirtspflanze zu überdauern. Das aktive Ausschleudern der Ascosporen geschieht im Herbst. Einige Kleistothecien können allerdings auch überwintern. Die Ascosporen infizieren je nach Rasse das aufgelaufene Wintergetreide oder andere Gräser. Hier überwintert der Pilz als Myzel auf lebenden, infizierten Pflanzen. In milden Wintern können auch Konidien bis ins Frühjahr am Leben bleiben, da diese gegen tiefe Temperaturen weniger empfindlich sind als gegen hohe (Blumer, 1967). In Gebieten mit kalten Wintern überlebt der Pilz als Ascospore in den Kleistothecien auf lebenden oder toten Pflanzenteilen. Sobald es die Temperaturen im Frühjahr zulassen, beginnt das Myzel wieder Konidien in Ketten zu produzieren.
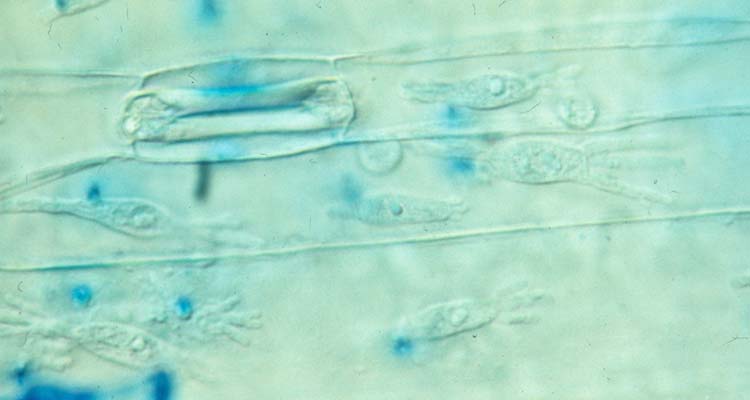 Abb. 6. Haustorien mit fingerförmigen Fortsätzen von Blumeria graminis in Epidermiszellen
Abb. 6. Haustorien mit fingerförmigen Fortsätzen von Blumeria graminis in Epidermiszellen
Epidemiologie
Vier Bedingungen sind für den optimalen Krankheitsverlauf der echten Mehltaupilze nötig: wenig Luftbewegung, eine hohe Luftfeuchtigkeit, eine geringe Lichtintensität (Schatten oder länger dauernde Bewölkung) und eine Lufttemperatur von ungefähr 17 - 22 °C. Intensive, lang andauernde Niederschläge wirken eher hemmend auf eine Mehltauepidemie. Da solche Verhältnisse in Mitteleuropa im Frühling und Herbst vorkommen, tritt diese Krankheit vor allem in dieser Periode an schattigen Lagen auf.
Echte Mehltaupilze sind obligate Parasiten, das heisst sie können nur lebendes grünes Pflanzengewebe befallen. Sie sind auf ein gutes Gedeihen ihrer Wirtspflanzen angewiesen. Eine ausreichende N-Düngung fördert die Entwicklung des Wirtes und indirekt auch die des Parasiten.
Wirtsspektrum
B. graminis befällt Weizen, Gerste, Roggen, Hafer sowie zahlreiche Futter- und Wildgräser. Die Art B. graminis besteht aus mindestens acht verschiedenen Spezialformen (formae speciales = f. sp.) (Tab. 1). Jede dieser Spezialformen parasitiert nur bestimmte Wirtspflanzen. Der Echte Mehltau der Raigräser kann zum Beispiel die Wiesenrispe nicht infizieren.
Innerhalb jeder forma specialis gibt es zahlreiche physiologische Rassen (Pathotypen). Diese haben einen Wirtspflanzenkreis, der jeweils eine oder mehrere Sorten von einer oder je nach Rasse mehreren Pflanzenarten umfasst.
Tab. 1: Acht Spezialformen (formae speciales = f. sp.) des Echten Mehltaus der Gräser (Blumeria graminis)
f. sp. tritici (Marchal) Weizen (Triticum aestivum), Triticum spp., Aegilops spp.
f. sp. hordei Gerste (Hordeum vulgare)
f. sp. secalis Roggen (Secale cereale)
f. sp. avenae Hafer (Avena sativa)
f. sp. agropyri Agropyron spp., Elymus spp.
f. sp. bromi Bromus spp.
f. sp. poae Wiesenrispe (Poa pratensis)
f. sp. lolii Raigras (Lolium multiflorum, L. perenne)
Eine Sorte kann die Fähigkeit haben, den Befall und die Besiedlung durch eine Mehltaurasse zu verhindern oder zu begrenzen. Die Mechanismen deren sich die Pflanze dabei bedient sind vielfältig.
Die am weitesten verbreitete Art der Resistenz ist die sogenannte Nicht-Wirt-Resistenz. Sie ist dauerhaft und unspezifisch, das heißt, alle Pflanzen einer Art sind gegen alle Rassen einer bestimmten forma specialis des echten Mehltaus resistent oder immun.
Ausserdem können die Pflanzen ein oder mehrere Resistenzgene enthalten, welche sie gegen bestimmte Rassen einer forma specialis resistent machen. Bei Weizen wurden bisher 48 Mehltauresistenzgene oder Allele (Pm Gene) identifiziert (Duveiller et al. 2007). In Gerstenpflanzen konnten sogar über 85 rassenspezifische Resistenzgene gefunden werden (Jorgensen 1994; Thordal-Christensen et al. 1999). Resistenzgene können innerhalb weniger Jahre ihre Wirksamkeit verlieren. Deshalb suchen die Pflanzenzüchter immer wieder neue. Die Züchter finden diese Gene in Landrassen, Wildgräsern oder bei verwandten Arten. Viele Resistenzgene können allerdings nicht genutzt werden, da sie mit negativen agronomischen Eigenschaften gekoppelt sind.
Daneben existiert auch noch die quantitative, horizontale oder rassenunspezifische Resistenz, die von mehreren Genen gesteuert wird. Die Wirkung der einzelnen Gene ist gering und wird oft von Umwelteinflüssen beeinflusst. Quantitative Resistenz wird meistens erst im adulten Stadium sichtbar. Der Befall der Pflanze wird nicht vollständig verhindert, es findet lediglich eine Reduzierung des Krankheitsbefalls statt. Dafür ist diese Art von Resistenz meist dauerhaft.
Bei der Gerste sind seit etwa 60 Jahren die so genannten mlo-Mutanten bekannt. Mehltaurassen, welche diese Getreidepflanzen befallen, werden beim Eindringen in die Epidermiszelle blockiert: Unterhalb der attackierten Epidermiszellen sterben die Zellen des Mesophyllgewebes ab. Diese mlo-bedingte Mehltauresistenz wird in der Gerstenzüchtung seit 25 Jahren intensiv genutzt, so dass etwa die Hälfte der derzeit in Mitteleuropa angebauten Gersten-Sorten diese Form der Resistenz besitzt. Die Besonderheit der mlo-Resistenz ist, dass sie nicht durch die Anwesenheit eines Resistenzproteins, sondern durch die Abwesenheit eines Proteins hervorgerufen wird, das vermutlich vom Pilzerreger als Eintrittspforte genutzt wird.
Vorbeugende Bekämpfungsmassnahmen
An den Futtergräsern verursacht der Pilz keine nennenswerten Schäden. Neuere Sorten sind resistent. (Schweiz: Liste der empfohlenen Sorten von Futterpflanzen)
Rasengräser, vor allem Poa und Festuca spp., werden in Schattenlagen oder während Perioden von tiefer Lichtintensität häufig vom echten Mehltau befallen. Hier lohnt es sich, resistente, Schatten tolerante Sorten zu verwenden. Auch muss dafür gesorgt werden, dass genügend Licht auf den Rasen kommt.
Literatur
Blumer S, 1967. Echte Mehltaupilze. Jena, VEB Gustav Fischer Verlag.
Duveiller E, Singh RP, Nicol JM, 2007. The challenges of maintaining wheat productivity: pests, diseases, and potential epidemics. Euphytica 157: 417-430.
Häni FJ, Popow G, Reinhard H, Schwarz A und Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Jorgensen J H, 1994. Genetics of powdery mildew resistance in barley. Critical Reviews in Plant Science 13, 97-119.
Mühle E, 1971. Krankheiten und Schädlinge der Futtergräser. S. Hirzel Verlag Leipzig. 422S.
Schmidt D, 1976. La sélection du dactyle pour la résistance à l'oidium (Erysiphe graminis DC.), La recherche agronomique en Suisse, Vol. 14, 305-321.
Schönbeck F, 1979. Pflanzenkrankheiten. B.G. Teubner Stuttgart: 184 S.
Thordal-Christensen H, Gregersen PL und Collinge D B, 1999. The barley/Blumeria (syn. Erysiphe) graminis interaction. In Mechanisms of resistance to plant diseases., A. Slusarenko, R. Fraser, and K. van Loon, eds. (Kluwer Academic Publishers), pp. 77-100.




