Schwarzrost des Getreides
rouille noire (fr.); stem rust oder black rust (engl.)
Wissenschaftlicher Name: Puccinia graminis ssp. graminis
Taxonomie: Fungi, Basidiomycota, Pucciniomycetes, Pucciniales, Pucciniaceae
früher: Heterobasidiomycetes, Uredinales, Pucciniaceae
Der Schwarzrost des Getreides (Puccinia graminis ssp. graminis) befällt Weizen, Triticale, Roggen, Hafer und gelegentlich auch die Gerste mit jeweils unterschiedlichen Formen: Der Weizenschwarzrost kann zum Beispiel den Roggen nicht infizieren und umgekehrt. Zwischenwirt dieses wirtswechselnden Rostpilzes ist die Berberitze (Berberis vulgaris) auf der er Spermogonien und Aecidien bildet.
Die Rostpusteln des Getreideschwarzrosts findet man vorwiegend auf Blattscheiden und Halmen (englisch: stem rust). Die Sporenlager sind von der aufgerissenen Epidermis umgeben.
Obwohl der Schwarzrost weltweit zu den gefährlichsten Getreideparasiten zählt, ist er in der Schweiz und Deutschland nur selten ertragsschädigend. Die Wahl von resistenten, frühreifen Sorten kann einem Befall vorbeugen. Der Beseitigung des Zwischenwirtes (Berberitze) sollte weiterhin Beachtung geschenkt werden.
 Abb. 1. Teleutolager der Puccinia graminis f.sp. secalis (Schwarzrost) an Halmen des Roggens (Secale cereale)
Abb. 1. Teleutolager der Puccinia graminis f.sp. secalis (Schwarzrost) an Halmen des Roggens (Secale cereale)
Bemerkungen zur Taxonomie der P. graminis
Puccinia graminis ist eine Kollektivart (Sammelart) und umfasst alle Rostpilze an Gräsern mit nackten Teleutolagern, die auf Berberis sp. (Berberitze) als Zwischenwirt hinüberwechseln (Gäumann 1959). Der gesamte Formenkreis umfasst Hunderte von Teleutosporen- und Dutzende von Aecidienwirten mit allen möglichen morphologischen und biologischen Besonderheiten. Innerhalb der Art P. graminis werden (je nach Autor) zahlreiche Subspezies (ssp.), Varietäten (var.) und formae speciales (f. sp.) unterschieden.
Urban (1967) teilt die Art P. graminis in die beiden Subspecies (ssp.) graminis und graminicola. Die erste Subspecies unterteilt er nochmals in die Varietäten (var.) graminis und stakmanii. Uredosporen der ssp graminis sind länglich-ellipsoidisch bis zylindrisch und 1.5 bis 1.8-mal breiter als diejenigen der breit-ellipsoidisch bis eiförmigen Uredosporen der ssp. graminicola. Die Uredosporen der var. graminis innerhalb der ssp. graminis sind etwas grösser als diejenigen der var. stakmanii.
P. graminis ssp. graminis var. graminis befällt Arten der Gattungen Triticum (Weizen), Aegilops und Elymus.
P. graminis ssp. graminis var. stakmanii wächst unter anderem auf Arten der Gattung Avena (Hafer), Hordeum (Gerste) und Secale (Roggen).
Die P. graminis ssp. graminicola parasitiert auf Arten der Gattungen Agrostis, Alopecurus, Arrhenatherum, Dactylis, Festuca, Lolium, Phleum, Poa und zahlreichen anderen Gräsern.
Der Schwarzrost des Getreides (P. graminis ssp. graminis) wird in drei formae speciales eingeteilt:
- f. sp. tritici (Erikss. et Henn.) kommt auf Weizen, gelegentlich auch auf einigen Arten der Gattungen Hordeum (zum Beispiel Gerste), Aegilops, Avena und Agropyron vor.
- f. sp. secalis befällt den Roggen und die Gerste sowie einige andere Gräser
- f. sp. avenae befällt Hafer sowie Flughafer und weitere Grasarten
Die Gerste kann sowohl von der f. sp. tritici und der f. sp. secalis infiziert werden.
Schadbild an Getreide und Schadwirkung
Während des Sommers erscheinen vorwiegend an den Blattscheiden, Halmen und Ähren (Spelzen und Spindeln) längliche, rötlich braune bis kaffeebraune Uredolager (Rostpusteln). Sie sind 2-3 mm lang und damit deutlich grösser als diejenigen der anderen Getreideroste. Die Uredolager wachsen häufig zusammen, so dass sie vor allem auf den Halmen ausgedehnte, streifenförmige Pusteln bilden und oft grosse Flächen bedecken. Nach dem Aufreissen der Epidermis über den sich bildenden Uredolagern (aufgerissene Epidermis am Rande der Pusteln deutlich sichtbar) wird eine pulverförmige Masse frei.
Die Teleutolager (Abb. 1 und 2) befinden sich vorwiegend auf den Blattscheiden und den Halmen. Sie sind schwarz-braun, länglich (bis zu 10 mm lang) und nur kurze Zeit von der Epidermis bedeckt. Die Reste der Epidermis sind meist beidseits der Lager sichtbar. Sie sind zerstreut angeordnet, einzelne Lager können ineinander fliessen und lange Streifen bilden.
Ein Befall der Halme mit Uredolagern erhöht den Wasserverbrauch der Pflanze. Zusätzlich wird die Epidermis durch den Rostpilz beschädigt, was die Verdunstung von Wasser nochmals erhöht.
Auch werden viele Nährstoffe, die normalerweise der Pflanze zur Verfügung stehen, vom Pathogen für die Produktion von Uredosporen verbraucht. Die Photosynthese von befallenen Pflanzen ist reduziert, da ein grosser Teil der grünen Pflanzenteile durch den Pilz zerstört ist. Dies alles bewirkt, dass für die Produktion einer normalen Anzahl Samen nicht genügend Wasser und Nährstoffe zur Verfügung stehen. Ausserdem reifen befallene Halme früher ab, es bleibt der Pflanze weniger Zeit, die Samen zu füllen.

 Abb. 2. Uredo- und Teleutolager des Schwarzrosts (Puccinia graminis f. sp. secalis) an Roggen
Abb. 2. Uredo- und Teleutolager des Schwarzrosts (Puccinia graminis f. sp. secalis) an Roggen
Krankheitserreger
Die Uredosporen (Abb. 3) sind länglich oval und 20-30 x 14-20 µm gross (Cummins 1971). Die Wand ist 1.5-2.5 µm dick, gelb bis goldbraun und besitzt entfernt stehende Stachelwarzen. Auffallend sind die vier (selten drei oder fünf) am Sporen-Äquator kreuzweise angeordneten Keimporen. Diese Anordnung der Keimporen ist für die Art typisch und als Erkennungsmerkmal gut geeignet.
Die Teleutosporen (Abb. 4) messen 34-60 x 16-23 µm (Cummins 1971). Ihre Form ist sehr unterschiedlich. Sie sind zweizellig, im Allgemeinen spindel- bis keulenförmig, in der Mitte leicht eingeschnürt und am Scheitel gerundet oder zugespitzt. Die Wand ist 1.5-2 µm dick (am Scheitel stark verdickt 5-11 µm), glatt, gelb- bis dunkel-braun. Die Teleutosporen haben typischerweise einen etwa 50 µm langen Stiel. Am Scheitel sind sie abgerundet bis leicht zugespitzt.
Die Spermogonien werden an der Blattoberseite der Berberitze auf orange bis rot gefärbten Flecken gebildet (Abb. 8). Sie entstehen unter der Epidermis, sind kugelig und haben einen Durchmesser von 120-130 µm. Die Empfängnishyphen ragen bis 60 µm hervor (Abb. 5).
Die becherförmigen, in Gruppen angeordneten Aecidien brechen an der Blattunterseite oder an Blattstielen hervor (Abb. 9). Im Innern werden Aecidiosporen (16-23 x 15-19 µm; Cummins 1971) gebildet (Abb. 6). Sie sind rundlich bis leicht oval. Die Wand ist dünn (1 µm), farblos und sehr fein warzig. Der Sporeninhalt ist gelb.
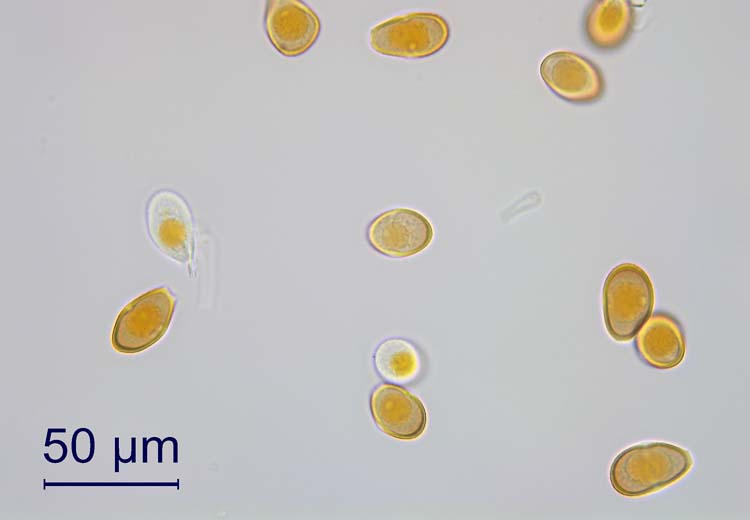
 Abb. 3. Uredosporen der Puccinia graminis, Verursacher des Schwarzrosts an Getreide
Abb. 3. Uredosporen der Puccinia graminis, Verursacher des Schwarzrosts an Getreide
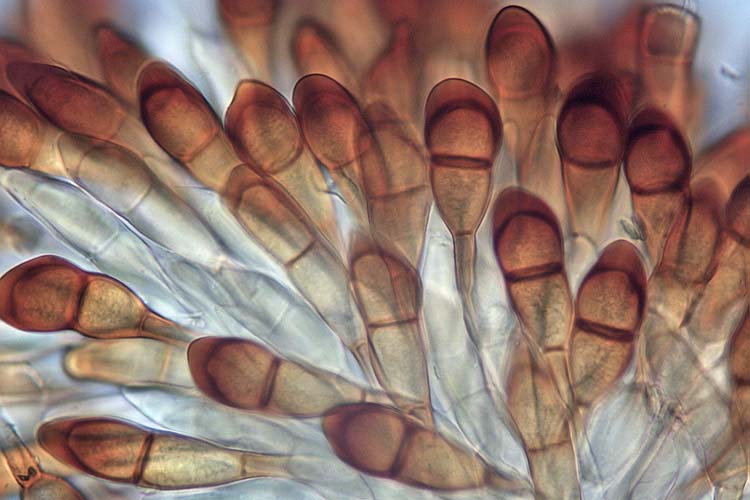
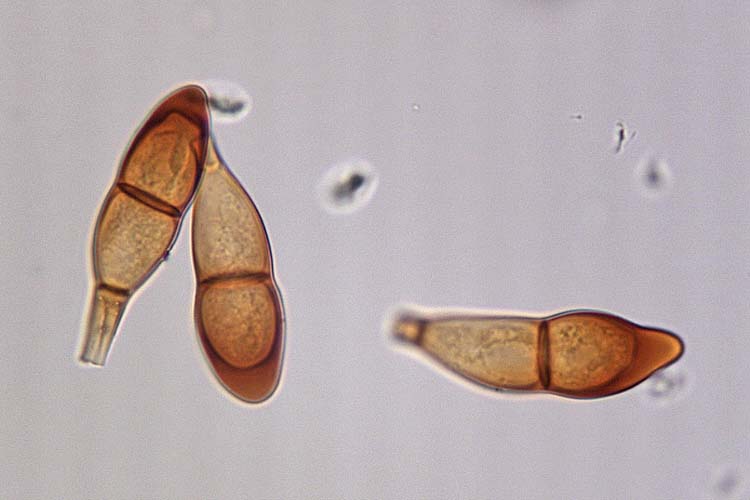 Abb. 4. Teleutosporen der Puccinia graminis f. sp. secalis, Verursacher des Schwarzrosts an Roggen
Abb. 4. Teleutosporen der Puccinia graminis f. sp. secalis, Verursacher des Schwarzrosts an Roggen
 Abb. 5. Spermogonium mit Empfängnishyphen der Puccinia graminis f. sp. secalis an Berberitze (Berberis vulgaris)
Abb. 5. Spermogonium mit Empfängnishyphen der Puccinia graminis f. sp. secalis an Berberitze (Berberis vulgaris)
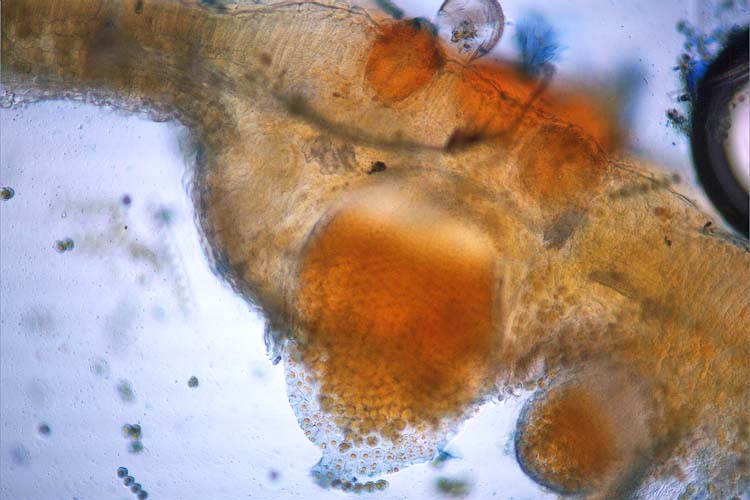 Abb. 6. Aecidium mit Aecidiosporen der Puccinia graminis f. sp. secalis an Berberitze (Berberis vulgaris)
Abb. 6. Aecidium mit Aecidiosporen der Puccinia graminis f. sp. secalis an Berberitze (Berberis vulgaris)
Lebenszyklus
Schwarzrost ist ein wirtswechselnder Rostpilz mit vollständigem Lebenszyklus. Im Sommer, etwa ab Juni, bildet der obligate Parasit Uredolager, vorwiegend an den Blattscheiden und Halmen, gelegentlich auch an den Blättern. In den Lagern wachsen zahlreiche Uredosporen, welche von der Luftströmung erfasst und auf andere Pflanzen übertragen werden. Starke Winde können die Sporen auch hunderte von Kilometer weit tragen und ermöglichen so dem Rostpilz, neue Gebiete zu besiedeln. Dies ist vor allem bei der grossräumigen Verbreitung der verschiedenen Rassen wichtig.
Bei Vorhandensein eines Wasserfilms auf der Blattoberfläche (zum Beispiel Tau im Sommer) keimen die Uredosporen und infizieren das Getreide durch die Spaltöffnungen (Stomata). Innerhalb von 8 – 14 Tagen nach der Inokulation werden neue Uredolager mit mehreren hunderttausend Sporen gebildet. Während einer Vegetationsperiode können bei günstigen Wetterverhältnissen mehrere Generationen von Sporen gebildet werden. Dabei entsteht eine gewaltige Menge Uredosporen.
Gegen Ende des Sommers entstehen entweder in den Uredolagern oder in neu gebildeten Lagern die Teleutosporen. Diese Sporen überwintern auf dem Pflanzenmaterial und keimen erst nach einer Ruhephase, meist im folgenden Frühjahr.
Während der Keimung erfolgt in den Teleutosporen die Karyogamie (Verschmelzung der zwei Zellkernen). Nach einer anschliessenden Meiose werden pro Zelle einer Teleutospore eine vierzellige Basidie und vier haploide Basidiosporen gebildet (Abb. 7). Die Basidiosporen gelangen mit dem Wind auf den Zwischenwirt, die Berberitze (Berberis vulgaris), ohne allerdings grössere Distanzen zurücklegen zu können.
Dort keimen die Basidiosporen aus und dringen direkt in die Epidermiszellen ein. Das haploide Myzel wächst interzellulär und bildet Haustorien in die Zellen, um sich zu ernähren.
Nach einigen Tagen entstehen an der Blattoberseite die Spermogonien (Abb. 6), in denen, eingebettet in einer klebrigen Flüssigkeit, Spermatien gebildet werden. Aus den Spermogonien ragen Empfängnishyphen. Insekten, die durch den spezifischen Duft der Spermogonien angelockt werden, übertragen die Spermatien auf sexuell kompatible Empfängnishypen. Spermatien werden auch durch Regen oder Tautropfen übertragen. Sobald ein Spermatium auf eine Empfängnishyphe eines kompatiblen Spermogoniums trifft, kommt es zur Befruchtung. Die beiden Kerne verschmelzen allerdings nicht. Der dikaryotische Zustand des Pilzes ist somit wieder hergestellt. Das dikaryotische Myzel bildet normalerweise an der Blattunterseite einen Knäuel, der sich zu einem Aecidium (Abb. 6) entwickelt. In den Aecidien werden in Ketten Aecidiosporen gebildet. Jede Spore enthält zwei separate Kerne, je einer eines entgegengesetzten Paarungstyps.
Die Aecidiosporen gelangen mit dem Wind auf nahe gelegenes Getreide, keimen dort unter günstigen Bedingungen aus und dringen durch die Spaltöffnungen ins Pflanzengewebe ein. Das Myzel wächst interzellulär, ernährt sich über Haustorien in den Wirtspflanzenzellen und bildet erneut Uredolager.
In kühleren Klimazonen muss der Schwarzrost den vollen Zyklus durchlaufen, um am Standort zu überleben. Allerdings können im Frühjahr Uredosporen über weite Strecken aus weit entfernten Gebieten (auf sogenannten Roststrassen) hereingeweht werden und das Getreide infizieren. In wärmeren Gebieten kann der Schwarzrost auch als Myzel auf lebendem Pflanzenmaterial oder als Uredospore überwintern.
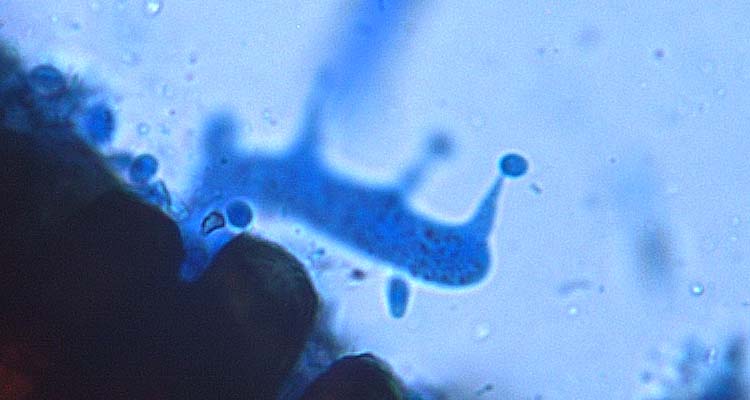 Abb. 7. gekeimte Teleutospore der Puccinia graminis f. sp. secalis: Basidie mit Basidiosporen
Abb. 7. gekeimte Teleutospore der Puccinia graminis f. sp. secalis: Basidie mit Basidiosporen
 Abb. 8. Spermogonien des Schwarzrosts (Puccinia graminis f. sp. secalis) an der Berberitze (Berberis vulgaris)
Abb. 8. Spermogonien des Schwarzrosts (Puccinia graminis f. sp. secalis) an der Berberitze (Berberis vulgaris)
 Abb. 9. Aecidien des Schwarzrosts (Puccinia graminis f.sp. secalis) an der Berberitze (Berberis vulgaris)
Abb. 9. Aecidien des Schwarzrosts (Puccinia graminis f.sp. secalis) an der Berberitze (Berberis vulgaris)
Epidemiologie
Im Allgemeinen braucht P. graminis für eine optimale Entwicklung eine etwas höhere Temperatur als der Gelbrost (P. striiformis). Nach Zadok (1965) sind 15-24 °C optimal für die Keimung der Uredosporen von P. graminis (auf Weizen) und 16-26 °C für die Bildung der Appressorien. Eine lange Periode mit wolkenlosen, sonnigen Tagen und kühlen Nächten sowie mit einer am Morgen lange dauernden Taubildung (mehr als 8 Stunden) ist für die Entstehung einer Schwarzrostepidemie optimal (Obst und Paul 1993). Sind die Temperaturen zudem günstig für die Keimung und die Bildung von Appressorien, können die Uredosporen schnell über die Spaltöffnungen in das Getreide eindringen (8-10 Stunden). Acht bis zehn Tage später entwickelt sich ein Uredolager, welches Uredosporen in grosser Zahl bilden. Jede dieser Spore kann wiederum Getreide infizieren und je ein Uredolager produzieren.
Obwohl der Schwarzrost zu den weltweit gefährlichsten Getreideparasiten zählt, tritt er in der Schweiz an Weizen nur noch in einzelnen Voralpentälern auf in denen zum Teil Sommerfrucht angebaut werden (Häni et al. 2008). Auch in Deutschland ist er selten ertragsschädigend (Obst und Paul 1993). An Roggen ist er hingegen häufig zu sehen. Es wird vermutet, dass der Roggenschwarzrost auf Wildgräsern in der Form von Mycel oder Uredosporen überwintern kann. Er tritt aber an Roggen zu spät auf, um noch einen Schaden anzurichten.
Wirtsspektrum
- Weizenschwarzrost (Puccinia graminis ssp. graminis f. sp. tritici) kommt an Weizen (Triticum aestivum) und Triticale vor, im Mittelmeerraum auch auf einigen Arten der Gattungen Hordeum, Aegilops, Avena und Agropyron (Obst und Paul 1993).
- Roggenschwarzrost (Puccinia graminis ssp. graminis f. sp. secalis) befällt den Roggen (Secale cereale) und gelegentlich auch die Gerste (Hordeum vulgare). Er kann aber Weizen nicht infizieren.
- Haferschwarzrost (Puccinia graminis ssp. graminis f. sp. avenae) parasitiert auf dem Hafer (Avena sativa), Flughafer und einigen Gräserarten.
- Gerste ist ein Spezialfall, weil sie von zwei verschiedenen formae speciales befallen wird, von der f. sp. tritici und der f. sp. secalis.
Zwischenwirt dieses wirtswechselnden Rostpilzes (gilt für alle drei formae speciales) ist die Berberitze (Berberis vulgaris), teilweise auch Mahonie-Arten, auf der er Spermogonien und Aecidien bildet.
Jede forma specialis des Schwarzrosts umfasst zahlreiche physiologische Rassen, die nur bestimmte Sorten oder Genotypen einer Wirtsart befallen. Eine Rasse hat die Fähigkeit bestimmte Resistenzgene zu überwinden (= Rasse ist virulent). Dies führt bei einer Pflanze, die nur dieses Resistenzgen enthält, zu einer Infektion und zur Bildung von Uredosporen. Pflanzen, die Resistenzgene enthalten, welche von dieser bestimmten Rasse nicht überwunden werden können (= Rostrasse ist avirulent), bleiben gesund. Hier setzt die Pflanzenzüchtung an. Sie versucht möglichst breit wirksame Resistenzgene in einer Pflanze oder Sorte zu vereinen, um diese gegen möglichst viele Rostrassen resistent zu machen. Die Resistenzzüchtung erleidet aber immer wieder Rückschläge, da neue Rostrassen durch die sexuelle Rekombination auf dem Zwischenwirt entstehen oder neue Rassen in ein vorher nicht besiedeltes Gebiet einwandern können.
Rasse UG99
Ug99 ist eine neue Rasse des Weizenschwarzrosts. Ihren Namen erhielt die Rasse, weil sie erstmals 1999 in Uganda entdeckt wurde. Seither hat Ug99 sich rasend schnell ostwärts verbreitet: Ausgehend von Ostafrika (Uganda, Kenia, Äthiopien usw.) hat sich Ug99 in wenigen Jahren auch in den Jemen und den Iran ausgebreitet (Vaidyanathan 2011). Agronomen befürchten jetzt, dass der Rost weiter nach Indien und China wandert und dort enorme Ernteverluste anrichten könnte. Auch die grossen Weizenanbaugebiete in Nordamerika sind bedroht. Hat sich Ug99 einmal in Mexiko etabliert, kann der Wind Uredosporen schnell bis hinauf nach Kanada tragen. Für die Schweizer Landwirtschaft ist Ug-99 vorerst keine grosse Gefahr. Uredosporen und Myzel der neuen Rasse des Schwarzrosts werden unsere kalten Winter nicht überleben. Ug99 müsste zuerst den Zwischenwirt infizieren oder es müssten jedes Jahr neue Sporen aus wärmeren Regionen im Süden auf die Felder im Norden gelangen.
Neunzig Prozent aller weltweit angebauten Weizensorten sind anfällig für Ug99. Sie alle tragen das Resistenzgen Sr31, das Ug99 überwunden hat. Sr31 liegt auf der 1BL.1RS Weizen-Roggen Translokation. Dieses Stück des Roggenchromosoms wurde aufgrund von wichtigen Resistenzgenen und besserem Ertrag weltweit in zahlreiche Weizensorten eingekreuzt.
Seit der Entdeckung von Ug99 wurden sieben Varianten der Ug99 gefunden, jede von ihnen kann eine andere Kombination von Resistenzgenen überwinden. Eine mögliche Erklärung für diese hohe Mutationsrate könnte die enorme Menge Sporen sein, die jedes Jahr in den betreffenden Ländern gebildet werden: Je grösser die Anzahl Sporen, desto häufiger findet man Mutationen.
Dies macht die Arbeit der Pflanzenzüchter nicht einfach. Sie versuchen die bereits bekannten rund fünfzig Resistenzgene und neue Resistenzquellen gegen Schwarzrost so zu kombinieren, dass die neu gezüchteten Linien resistent sind. Ein anderer Ansatz ist die Verwendung von sogenannten „minor genes" mit einer quantitativen Wirkung. Das heisst jedes dieser Gene erhöht die Resistenz gegen Schwarzrost, unabhängig von der Rostrasse, nur gering. Durch die Kombination von mehreren solcher „minor genes" wird die Wirkung aber gegenseitig verstärkt. Eine solche Resistenz ist zudem dauerhaft.
Im Jahre 2005 entstand ein internationales Konsortium zur Bekämpfung von Ug99, die Borlaug Global Rust Initiative (BGRI). Ziel ist es, gegen Schwarzrost resistente Weizensorten für afrikanische und asiatische Länder zu züchten.
Vorbeugende Massnahmen und Bekämpfung
Schwarzrost ist in Nordamerika wie auch weltweit eine gefürchtete Krankheit des Weizens. Eine grossflächige Rodung der Berberitze hatte in Nordamerika einen grossen Erfolg. Der Entwicklungszyklus des Schwarzrosts wurde vor Ort unterbrochen. Eine Epidemie, verursacht durch aus dem Süden eingeflogene Uredosporen, fängt viel später an und hat nicht mehr diese verheerende Wirkung wie früher.
In der Schweiz drängen sich keine speziellen Massnahmen auf, da der Schwarzrost des Getreides bei uns selten in nennenswertem Ausmass vorkommt. Im Übrigen können folgende vorbeugende Massnahmen getroffen werden:
- mit einer angepassten Düngung wird die Pflanzenentwicklung gefördert
- frühreife und wenig anfällige oder resistente Sorten anbauen (die Anfälligkeit der Weizensorten für Schwarzrost ist in der für Österreich geltenden Sortenliste beschrieben)
- den Zwischenwirt Berberitze nicht in Hecken anpflanzen oder gegebenenfalls vernichten
Literatur
Cummins GB, 1971. The rust Fungi of Cereals, Grasses and Bamboos. Springer Verlag Berlin: 570 S.
Gäumann E, 1959. Beiträge zur Kryptogamenflora der Schweiz (Band XII): Die Rostpilze Mitteleuropas, Büchler und Co. 1407 S.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Obst A, Paul V, 1993. Krankheiten und Schädlinge des Getreides. Verlag Th. Mann: 184 S.
Urban Z, 1967. The taxonomy of some European graminicolous rusts. Ceska Mykol. 21, 12-16.
Vaidyanathan G, 2011. The wheat stalker. Nature, Vol. 474:563-565.
Zadoks JC, 1965. Epidemiology of wheat rusts in Europe. FAO Plant Prot. Bull., 13 (5): 97-108.




