Schwarzrost
rouille noire (fr.); stem rust (engl.)
Wissenschaftlicher Name: Puccinia graminis Pers. f. sp. graminicola
Taxonomie: Fungi, Basidiomycota, Pucciniomycetes, Incertae sedis, Puccinales, Pucciniaceae
Schwarzrost (Puccinia graminis f. sp. graminicola) befällt vorwiegend die Blattscheiden und die Halme der Gräser (englisch: stem rust). Diese Rostkrankheit ist vor allem in der Saatgutproduktion gefürchtet und vermindert den Samenertrag deutlich. An den Blättern verursacht sie in den seltensten Fällen einen nennenswerten Schaden.


 Abb. 1. Uredolager von Schwarzrost (Puccinia graminis) an Halmen und Blättern des Rohrschwingels (Festuca arundinacea)
Abb. 1. Uredolager von Schwarzrost (Puccinia graminis) an Halmen und Blättern des Rohrschwingels (Festuca arundinacea)

 Abb. 2. Uredolager von Schwarzrost an Rotschwingel (Festuca rubra)
Abb. 2. Uredolager von Schwarzrost an Rotschwingel (Festuca rubra)
Schadbild
Im Sommer erscheinen vorwiegend an den Blattscheiden, an den Halmen und Ähren (inklusive Spelzen und Spindeln) längliche, rötlich braune bis kaffeebraune Uredolager. Während heisser Sommer werden auch die Blätter von vegetativ wachsenden Gräsern befallen. Die Uredolager sind 2-3 mm lang (Abb. 1 bis 3) und damit deutlich grösser als diejenigen des Kronenrostes. Die Uredolager wachsen häufig zusammen, so dass sie vor allem an den Halmen ausgedehnte, streifenförmige Pusteln bilden und oft grosse Flächen bedecken. Nach dem Aufreissen der Epidermis über den Uredolagern wird eine pulverförmige Masse frei.
Die Teleutolager (Abb. 4) befinden sich vorwiegend an den Blattscheiden oder den Halmen. Sie sind schwarz-braun, länglich (bis zu 10 mm lang) und nur kurze Zeit von der Epidermis bedeckt. Die Reste der Epidermis sind häufig noch beidseits der Lager sichtbar. Sie sind zerstreut angeordnet, einzelne Lager können ineinander fliessen und lange Streifen bilden.
 Abb. 3. Schwarzrost (Puccinia graminis) an den Ähren des Deutschen Weidelgrases / Englischen Raigrases (Lolium perenne)
Abb. 3. Schwarzrost (Puccinia graminis) an den Ähren des Deutschen Weidelgrases / Englischen Raigrases (Lolium perenne)
 Abb. 4. Schwarzrost (Puccinia graminis) an Roggen (Secale cereale): Teleutolager
Abb. 4. Schwarzrost (Puccinia graminis) an Roggen (Secale cereale): Teleutolager
Lebenszyklus
Schwarzrost ist ein wirtswechselnder Rostpilz mit vollständigem Lebenszyklus. Von Juli bis Oktober bildet der obligate Parasit Uredolager vorwiegend an den Blattscheiden und Halmen, gelegentlich auch an den Blättern. In den Lagern wachsen zahlreiche Uredosporen, welche von der Luftströmung erfasst und auf andere Gräser übertragen werden. Starke Winde können die Sporen hunderte von Kilometer weit tragen und ermöglichen so dem Rostpilz, neue Gebiete zu besiedeln. Dies ist vor allem bei der grossräumigen Verbreitung der verschiedenen Rassen wichtig.
Bei Vorhandensein eines Wasserfilms an der Blattoberfläche (zum Beispiel Tau im Sommer) keimen die Uredosporen und infizieren die Gräser über die Spaltöffnungen (Stomata). Innerhalb von 8 – 14 Tagen nach der Inokulation werden neue Uredolager mit mehreren hunderttausend Sporen gebildet. Während einer Vegetationsperiode können so bei günstigen Wetterverhältnissen mehrere Generationen und gewaltige Massen von Uredosporen gebildet werden.
Gegen Ende des Sommers entstehen entweder in den bestehenden Uredolagern oder in neu gebildeten Lagern die Teleutosporen. Diese Sporen überwintern auf dem Pflanzenmaterial und keimen erst nach einer Ruhephase, meist im folgenden Frühjahr.
Während der Keimung erfolgt in den Teleutosporen die Karyogamie (Verschmelzung der beiden Kerne: Rostpilze sind Dikaryoten). Nach einer anschliessenden Meiose werden pro Zelle einer Teleutospore eine vierzellige Basidie und vier haploide Basidiosporen gebildet. Die Basidiosporen gelangen mit dem Wind auf den Zwischenwirt Berberitze (Berberis vulgaris), ohne allerdings grössere Distanzen zurücklegen zu können. Dort keimen die Basidiosporen und dringen direkt in die Epidermiszellen ein. Das haploide Myzel wächst interzellulär und bildet Haustorien in die Zellen um sich zu ernähren.
Nach einigen Tagen entstehen an der Blattoberseite die Spermogonien (Abb. 6), in denen, eingebettet in einer klebrigen Flüssigkeit, Spermatien gebildet werden. Aus den Spermogonien wachsen Empfängnishyphen. Insekten, die durch den spezifischen Duft der Spermogonien angelockt werden, übertragen die Spermatien auf sexuell kompatible Empfängnishypen. Spermatien können auch durch Regen oder Tautropfen übertragen werden. Sobald ein Spermatium auf eine Empfängnishyphe eines kompatiblen Spermogoniums trifft, kommt es zur Befruchtung. Die beiden Kerne verschmelzen allerdings nicht, so dass der dikaryotische Zustand des Pilzes wieder hergestellt ist. Das dikaryotische Myzel bildet normalerweise an der Blattunterseite einen Knäuel, der sich zu einem Aecidium (Abb. 5) entwickelt. In den Aecidien werden in Ketten Aecidiosporen gebildet. Jede Spore enthält zwei separate Kerne, je einer eines entgegengesetzten Paarungstyps.
Die Aecidiosporen gelangen mit dem Wind auf nahe gelegene Gräser, keimen dort unter günstigen Bedingungen aus und dringen durch die Spaltöffnungen ins Pflanzengewebe ein. Das Myzel wächst interzellulär, ernährt sich über Haustorien in den Wirtspflanzenzellen und bildet erneut Uredolager.
In kühleren Klimazonen muss der Schwarzrost den vollen Zyklus durchlaufen, um am Standort zu überleben. In wärmeren Gebieten kann er auch als Myzel auf lebendem Pflanzenmaterial oder als Uredospore überwintern.
 Abb. 5. Aecidien der Puccinia graminis (Schwarzrost) an Berberitze (Berberis vulgaris)
Abb. 5. Aecidien der Puccinia graminis (Schwarzrost) an Berberitze (Berberis vulgaris)

 Abb. 6. Spermogonien (oben links) und Aecidien des Schwarzrostes an der Berberitze (Berberis vulgaris)
Abb. 6. Spermogonien (oben links) und Aecidien des Schwarzrostes an der Berberitze (Berberis vulgaris)
Krankheitserreger
Die Uredosporen (Abb. 7) sind länglich oval und 20-30 x 14-20 µm gross (Cummins 1971). Die Wand ist 1.5-2.5 µm dick, gelb bis goldbraun und besitzt entfernt stehende Stachelwarzen. Auffallend sind die am Sporen-Äquator kreuzweise angeordneten vier (selten drei oder fünf) Keimporen. Diese Anordnung der Keimporen ist für die Art typisch und als Erkennungsmerkmal gut geeignet.
Die Teleutosporen (Abb. 7) messen 34-60 x 16-23 µm (Cummins 1971). Ihre Form ist sehr unterschiedlich: zweizellig, im allgemeinen spindel- bis keulenförmig, in der Mitte leicht eingeschnürt und am Scheitel gerundet oder zugespitzt. Die Wand ist 1.5-2 µm dick (am Scheitel stark verdickt 5-11 µm), glatt, gelb- bis dunkel-braun. Die Teleutosporen haben typischerweise einen etwa 50 µm langen Stiel. Am Scheitel sind sie abgerundet bis leicht zugespitzt.
Die Spermogonien werden auf der Blattoberseite der Berberitze auf orange bis rot gefärbten Flecken gebildet (Abb. 6). Sie entstehen unter der Epidermis, sind kugelig und haben einen Durchmesser von 120-130 µm. Die Empfängnishyphen ragen bis 60 µm hervor.
Die becherförmigen, in Gruppen angeordneten Aecidien brechen auf der Blattunterseite oder auf Blattstielen hervor (Abb. 6). Im Inneren werden Aecidiosporen (16-23 x 15-19 µm; Cummins 1971) gebildet. Sie sind rundlich bis leicht oval. Die Wand ist dünn (1 µm), farblos und sehr fein warzig. Der Sporeninhalt ist gelb.
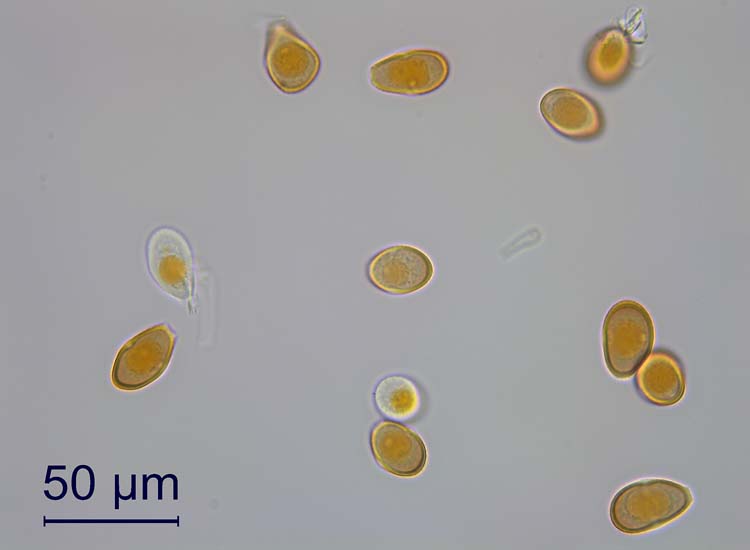
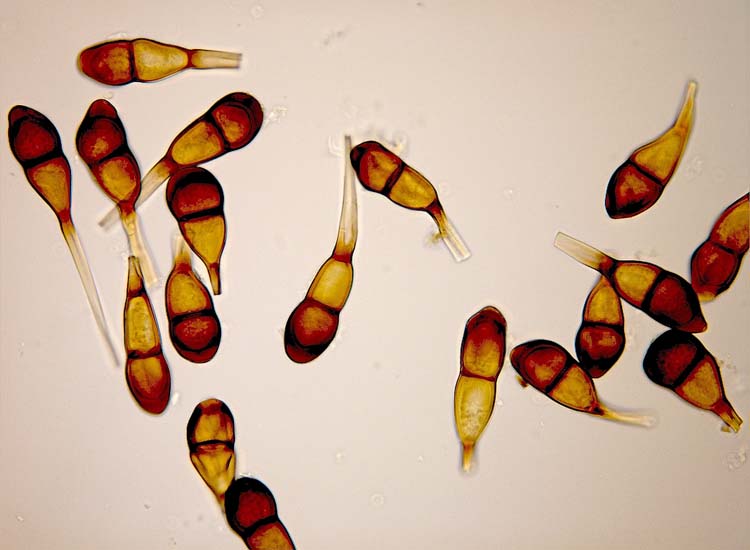 Abb. 7. Uredo- (oben) und Teleutosporen (unten) der Puccinia graminis (Schwarzrost)
Abb. 7. Uredo- (oben) und Teleutosporen (unten) der Puccinia graminis (Schwarzrost)
Epidemiologie
Im Allgemeinen benötigt P. graminis für eine optimale Entwicklung eine etwas höhere Temperaturen als P. striiformis. Nach Zadok (1965) sind 15-24 °C optimal für die Keimung der Uredosporen von P. graminis (Weizen) und 16-26 °C für die Bildung der Appressorien. Eine lange Periode mit wolkenlosen, sonnigen Tagen und kühlen Nächten, sowie mit einer am Morgen lange dauernden Taubildung, ist für die Entstehung einer Schwarzrostepidemie optimal. Sind die Temperaturen zudem günstig für die Keimung und die Bildung von Appressorien, können die Uredosporen schnell über die Spaltöffnungen in die Gräser eindringen. Acht bis zwölf Tage später entwickelt sich ein Uredolager, welches Uredosporen in grosser Zahl bildet. Jede dieser Spore kann wiederum Gräser infizieren und je ein Uredolager produzieren.
In der Schweiz erscheint der Schwarzrost an Gräsern Ende Juni. Der dritte und vierte Aufwuchs (August bis anfangs September) ist am stärksten befallen, erreicht aber selten ein schädigendes Ausmass.
Schaden
Schwarzrost ist vor allem in der Saatgutproduktion gefürchtet und vermindert den Samenertrag deutlich. Betroffen sind Englisches Raigras / Deutsches Weidelgras (Lolium perenne), Wiesenschwingel (Festuca pratensis), Rohrschwingel (F. arundinacea), Knaulgras (Dactylis glomerata), Wiesenrispe (Poa pratensis) und Kammgras (Cynosorus cristatus). Falls bereits vor oder während der Blüte eine Infektion stattgefunden hat, kann dies sogar zu einem Totalausfall der Ernte führen.
Ein Befall der Halme mit zahlreichen Uredolagern erhöht den Wasserverbrauch der Pflanze. Zusätzlich wird die Epidermis durch den Rostpilz beschädigt, was die Verdunstung von Wasser nochmals erhöht.
Auch werden viele Nährstoffe, die normalerweise der Pflanze zur Verfügung stehen, vom Pathogen für die Produktion von Uredosporen verbraucht. Die Photosynthese von befallenen Pflanzen ist reduziert, da ein grosser Teil der grünen Pflanzenteile durch den Pilz zerstört ist. Dies alles bewirkt, dass für die Produktion einer normalen Anzahl Samen nicht genügend Wasser und Nährstoffe zur Verfügung stehen. Ausserdem reifen befallene Halme früher ab, es bleibt der Pflanze weniger Zeit die Samen zu füllen.
Wirtsspektrum
Puccinia graminis ist eine Kollektivart (Sammelart) und umfasst alle Rostpilze auf Gräsern mit nackten Teleutolagern, die auf Berberis sp. hinüberwechseln (Gäumann 1959). Der gesamte Formenkreis umfasst Hunderte von Teleutosporen- und Dutzende von Aecidienwirte mit allen möglichen morphologischen und biologischen Besonderheiten. Innerhalb der Art P. graminis werden (je nach Autor) zahlreiche formae speciales (=Subspecies) und Varietäten unterschieden.
Cummins (1971) unterscheidet innerhalb der Art P. graminis die beiden Subspecies: ssp. graminis und ssp. graminicola. Die erste unterteilt er nochmals in die Varietät (var.) graminis und var. stakmanii. P. graminis ssp. graminis var. graminis befällt Arten der Gattungen Triticum (Weizen), Aegilops und Elymus. Var. stakmanii wächst unter anderem auf Arten der Gattung Avena (Hafer), Hordeum (Gerste), und Secale (Roggen). Die P. graminis ssp. graminicola parasitiert auf Arten der Gattungen Agrostis, Alopecurus, Arrhenatherum, Dactylis, Festuca, Lolium, Phleum, Poa und zahlreichen anderen Gräsern.
Jede forma specialis umfasst wiederum zahlreiche physiologische Rassen mit unterschiedlichem Virulenzspektrum. Oder mit anderen Worten, eine Rasse befällt nur bestimmte Sorten oder Genotypen einer Wirtsart. Eine Rasse hat die Fähigkeit bestimmte Resistenzgene zu überwinden. Dies führt bei einer Pflanze, die nur dieses Resistenzgen enthält, zu einer Infektion und zur Bildung von Uredosporen. Pflanzen die Resistenzgene enthalten, welche von dieser bestimmten Rasse nicht überwunden werden können (= Rostrasse ist avirulent), bleiben gesund. Hier setzt die Pflanzenzüchtung an. Sie versucht möglichst breit wirksame Resistenzgene in einer Pflanze oder Sorte zu vereinen um diese gegen möglichst viele Rostrassen resistent zu machen. Die Resistenzzüchtung erleidet aber immer wieder Rückschläge, da neue Rostrassen entstehen oder neue Rassen in ein vorher nicht besiedeltes Gebiet einwandern können.
Vorbeugende Bekämpfungsmassnahmen
Schwarzrost ist in Nordamerika wie auch in Europa eine gefürchtete Krankheit des Weizens. Eine grossflächige Rodung der Berberitze hatte in Nordamerika einen grossen Erfolg. Der Entwicklungszyklus des Schwarzrosts wurde vor Ort unterbrochen. Eine Epidemie, verursacht durch aus dem Süden eingeflogene Uredosporen, fängt viel später an und hat nicht mehr diese verheerende Wirkung wie früher.
Auf unseren Wiesen drängen sich keine speziellen Massnahmen auf, da der Schwarzrost bei uns selten in nennenswertem Ausmass vorkommt. Im Übrigen gelten für den Schwarzrost die gleichen Bekämpfungsmassnahmen wie für den Kronenrost:
- mit Schwarzrost befallene Wiesen häufiger schneiden
- mit einer angepassten Düngung wird ein ausgeglichener Bestand angestrebt (kein zu hoher Anteil an Gräsern)
- Verwendung von resistenten Schweizer Raigrassorten (Liste der empfohlenen Sorten von Futterpflanzen, für die Schweiz)
Anders ist die Situation in der Saatgutproduktion. Hier muss häufig mit Fungiziden gegen den Schwarzrost behandelt werden. Eine Behandlung erfolgt beim Sichtbarwerden der ersten Befallssymptome ab Schossbeginn bis Beginn der Blüte. Im Behandlungsjahr darf anfallendes Erntegut/Mähgut nicht verfüttern werden.
Literatur
Cummins GB, 1971. The rust Fungi of Cereals, Grasses and Bamboos. Springer Verlag Berlin: 570 S.
Gäumann E, 1959. Beiträge zur Kryptogamenflora der Schweiz (Band XII): Die Rostpilze Mitteleuropas, Büchler und Co. 1407 S.
Zadoks JC, 1965. Epidemiology of wheat rusts in Europe. FAO Plant Prot. Bull., 13 (5): 97-108.




