Roggenbraunrost
rouille brune (franz.), leaf rust of rye or brown rust (engl.)
Wissenschaftlicher Name: Puccinia recondita Rob. ex Desm. f. sp. secalis
Synonym: P. dispersa Erikss. et Henn.
Taxonomie: Fungi, Basidiomycota, Pucciniomycetes, Incertae sedis, Pucciniales, Pucciniaceae
Der Roggenbraunrost (Puccinia recondita f. sp. secalis) kommt in allen Roggenanbaugebieten der Welt vor und ist meist ein wichtiger Schaderreger. Er ist ein wirtswechselnder Rostpilz mit vollständigem Entwicklungsgang. Als Zwischenwirt dient die Ochsenzunge (Anchusa sp.), der Natternkopf (Echium sp.) und andere Vertreter der Raublattgewächse. Ein starker Befall beeinträchtigt den Ertrag und die Qualität des Getreides. Die wichtigsten vorbeugenden Massnahmen zur Verhinderung eines Braunrostbefalls sind: Anbau von resistenten, frühreifen Roggensorten, Winterroggen nicht zu früh säen, Ausfallroggen und Stoppeln vor dem Auflaufen der Herbstsaat vernichten.


 Abb. 1. Roggenbraunrost (Puccinia recondita f.sp. secalis): Uredolager vorwiegend an der Blattoberseite
Abb. 1. Roggenbraunrost (Puccinia recondita f.sp. secalis): Uredolager vorwiegend an der Blattoberseite
 Abb. 2. Roggenbraunrost (Puccinia recondita f. sp. secalis): Teleutolager an der Blattunterseite
Abb. 2. Roggenbraunrost (Puccinia recondita f. sp. secalis): Teleutolager an der Blattunterseite
Bemerkungen zur Taxonomie
Der Braunrost an Roggen (Secale cereale) wurde erstmals im Jahre 1894 von Eriksson und Henning erwähnt und als Puccinia dispersa Erikss. et Henn. beschrieben. Wegen seiner Ähnlichkeit zum Weizenbraunrost wurde er 1966 von Wilson und Henderson der Sammelart Puccinia recondita Rob. ex Desm. zugeordnet. Innerhalb dieser Artengruppe gab es grosse Unterschiede zwischen den Populationen sowohl in der Morphologie als auch im Wirtspflanzenspektrum. Je nach Wirtspflanzen des Dikaryonten und des dazugehörenden Haplonten wurden zahlreiche formae speciales (f. sp.) beschrieben. Der Braunrost des Weizens wurde zur P. recondita f. sp. tritici, der Braunrost des Roggens zur f. sp. secalis. Der Weizenbraunrost wurde später als eine eigene Art angesehen und wird gemäss geltender Regel heute P. triticina Eriks. genannt.
Schadbild
Erste Rostpusteln können schon früh im Herbst oder Winter an Roggen beobachtet werden. Meist erscheinen sie aber erst ab Mitte Mai, vorwiegend an der Oberseite der Roggenblätter (Abb. 1). Die rostbraunen Uredolager (Sommersporenlager) sind zerstreut über die ganze Blattfläche verteilt (und nicht in Reihen oder Streifen wie beim Gelbrost, P. striiformis), selten wachsen sie auch an den Blattscheiden und Ähren. Die Lager sind länglich-oval. Im Unterschied zum Schwarzrost (P. graminis) bleiben weniger Epidermisreste am Rande der Lager hängen. Stark befallene Blätter sterben vorzeitig ab.
Gegen Ende der Vegetation bildet der obligate Parasit an der Blattunterseite, selten auch an der Blattscheide, Teleutosporenlager (Wintersporenlager). Diese sind schwarz, länglich und bleiben von der Epidermis bedeckt (Abb. 2).
Krankheitserreger
Die Uredosporen (Abb. 3) sind kugelig bis ellipsoidisch und im Mittel 23.2 µm lang und 20.4 µm breit (Gäumann 1959). Sie haben 8-10 gleichmässig verteilte Keimporen und sind mit Stachelwarzen versehen. Die Uredosporen sind orangebraun (nicht hyalin wie bei P. striiformis). Es gibt keine Paraphysen in den Uredolagern.
Die braunen bis schwarzen Teleutosporen sind zweizellig (Abb. 4), länglich keulenförmig (45.9 µm lang und 16.3 µm breit, oft abgestumpft oder schräg gestutzt. Die untere Zelle ist meist schmäler und länger als die obere. Die Keimporen sind nicht sichtbar. Der Stiel ist kurz. Bräunliche Paraphysen unterteilen die grossen Lager in kleinere Lager.
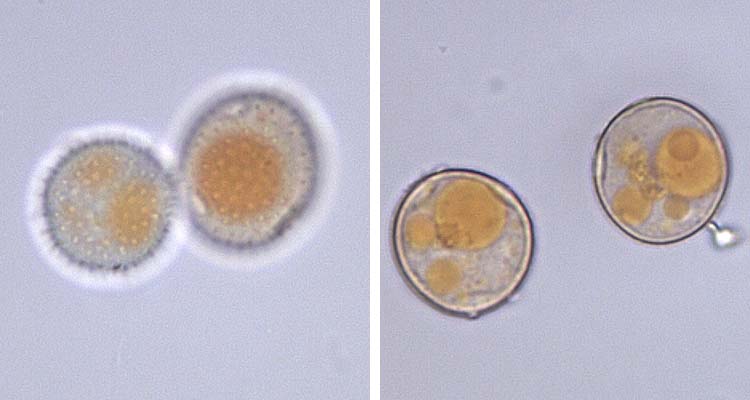 Abb. 3. Roggenbraunrost (Puccinia recondita f.sp. secalis): Uredosporen mit Stachelwarzen und Keimpore
Abb. 3. Roggenbraunrost (Puccinia recondita f.sp. secalis): Uredosporen mit Stachelwarzen und Keimpore
 Abb. 4. Roggenbraunrost (Puccinia recondita f. sp. secalis): Teleutosporen
Abb. 4. Roggenbraunrost (Puccinia recondita f. sp. secalis): Teleutosporen
Lebenszyklus
Roggenbraunrost ist ein wirtswechselnder (heterözischer) Rostpilz mit vollständigem (makrozyklischem) Entwicklungsgang. Er bildet die dikaryotischen Uredosporen in Uredolagern auf Roggenblättern. Die Uredosporen infizieren wiederum den Roggen. Unter günstigen Witterungsbedingungen kommt es zu einer epidemieartigen Ausbreitung des Rostpilzes. Mit zunehmender Reife des Roggens werden in Teleutolagern an der Blattunterseite Teleutosporen gebildet. Diese sind vorerst ebenfalls dikaryotisch. Die beiden haploiden Zellkerne verschmelzen aber schon bald zu einem diploiden Zellkern (Karyogamie).
Teleutosporen sind Dauersporen und können den Sommer und Winter überdauern. In gemässigten Klimas ist der Braunrost nicht auf den Zwischenwirt angewiesen. Er überdauert hier den Winter meist als Myzel oder Uredospore auf Ausfall- und/oder Winterroggen.
Makrozyklische Entwicklung: Im Herbst oder im Frühjahr keimt eine oder beide Zellen der Teleutospore mit einem Promyzel. Der diploide Zellkern teilt sich in einer Meiose in vier haploide Zellkerne. Diese wandern in das Promyzel, welches sich anschliessend mittels Septen in vier Zellen mit je einem haploiden Zellkern unterteilt. Letzterer fliesst anschliessend durch die Sterigmen in die neu entstehenden Basidiosporen. Die Basidiosporen werden abgestossen und gelangen mit der Luftströmung auf den Zwischenwirt, die Ochsenzunge (Anchusa sp.), der Natternkopf (Echium sp.) oder andere Vertreter der Raublattgewächse. Auf dem Zwischenwirt keimen die Basidiosporen und dringen direkt in das Blatt ein. Es kommt zur Bildung von flaschenförmigen Spermogonien (Pyknidien), in denen Spermatien (früher Pyknosporen genannt) und Empfängnishyphen gebildet werden. Regentropfen, Tau oder Insekten, angelockt durch ein von den Spermogonien ausgeschiedener „Nektar", übertragen die Spermatien auf sexuell kompatible Empfängnishyphen. Nach der Befruchtung entwickeln sich auf der Blattunterseite Aecidien, in denen in Ketten angeordnete, dikaryotische Aecidiosporen wachsen. Auf der Ochsenzunge (Anchusa sp.) können Aecidien vom Frühling bis Herbst beobachtet werden. Die Aecidiosporen infizieren nun wiederum den Hauptwirt, den Roggen.
Infektionsvorgang
Uredosporen können mit dem Wind über mehrere Kilometer verbreitet werden. Gelangt eine virulente Uredospore auf ein anfälliges Roggenblatt und ist dort ein Wasserfilm vorhanden (Regen oder Tau), beginnt die Spore zu keimen. Der Keimschlauch wächst auf der Blattoberfläche senkrecht zu der Längsachse der Epidermiszellen bis er auf eine Spaltöffnung (Stoma) trifft. Dort wird ein Appressorium gebildet. Eine Penetrationshyphe dringt durch die geschlossene Spaltöffnung in die Pflanze und entwickelt ein substomatäres Vesikel. Aus diesem entsteht die Infektionshyphe, die solange wächst bis sie auf eine Mesophyllzelle trifft. An der Spitze der Infektionshyphe wird eine Haustorienmutterzelle abgeschnürt. Ausgehend von dieser Zelle durchwächst der Pilz die pflanzliche Zellwand und bildet in der Pflanzenzelle ein Haustorium. Bei der Bildung des Haustoriums wird das Plasmalemma der Wirtszelle eingestülpt und umschließt als extrahaustoriale Membran das Haustorium, so dass dieses nicht direkt in Kontakt mit dem Cytoplasma ist. Das Haustorium ist eine spezialisierte pilzliche Hyphe, die der Nährstoffversorgung des Pilzes dient, ohne dabei die Wirtszelle abzutöten. Von der Infektionshyphe aus entstehen weitere Haustorienmutterzellen, die Haustorien in benachbarte Mesophyllzellen senden.
Gelangt eine avirulente Uredospore auf eine resistente Roggenpflanze dringt diese wie oben beschrieben in das Blatt ein. Die Entwicklung des Haustoriums wird aber verhindert, weil die Pflanzenzelle eine hypersensitive Resistenzreaktion auslöst, durch die sich die Zelle selbst tötet.
Sieben bis zehn Tage nach Beginn der Infektion entstehen Sporenmutterzellen, welche die ersten Uredosporen abschnüren. In der Folge bricht die Epidermis auf und die Sporen können vom Wind fortgetragen werden. Auf sehr anfälligen Roggenpflanzen werden rund um das primäre Uredolager noch weitere sekundäre Sporenlager gebildet. Auch 16 Tage nach dem Eindringen des Pilzes in die Pflanze sind als Folge der Infektion erst wenige Pflanzenzellen abgestorben.
Braunrostrassen
Rassen unterscheiden sich in ihrer Fähigkeit, bestimmte Roggensorten zu befallen oder eben nicht zu befallen. Spezifische Gene des Rostpilzes bestimmen seine Virulenz oder Avirulenz. Die Interaktion dieser Gene mit spezifischen Genen der Wirtspflanze (Resistenzgene) bestimmt den Infektionstyp auf einer Sorte. Neue Braunrostrassen entstehen auf dem Zwischenwirt durch Genrekombination oder durch natürlich vorkommende zufällige Mutationen in den Uredosporen. Häufig kommt es vor, dass Rostrassen in ein Gebiet einfliegen oder eingeschleppt werden, wo sie bis anhin nicht auftraten. Dies kann bei den Rostpilzen über sehr grosse Distanzen stattfinden.
Über die vorkommenden Rassen in den Braunrostpopulationen an Roggen ist noch sehr wenig bekannt. Klocke (2004) und Miedaner et al. (2012) untersuchten die Virulenzstruktur und –dynamik der deutschen Roggenbraunrostpopulationen. Sie konnten zwischen schwach bis hoch virulenten Isolaten unterscheiden.
Epidemiologie
Roggenbraunrost kann sich in einem weiten Temperaturbereich vermehren. Im Vergleich zum Weizenbraunrost ist er aber etwas besser an tiefere als an hohe Temperaturen angepasst (Obst und Paul 1993). Er entwickelt sich bei Tagestemperaturen von 20-26 °C und kühlen Nächten (nicht unter 12 °C) mit starker Taubildung besonders gut. Eine intensive Lichteinstrahlung fördert die Sporenbildung zusätzlich.
Der Anbau von anfälligen Sorten, eine hohe Stickstoffversorgung, mildes Herbst- und Winterwetter sowie ein warmes Frühjahr fördern den Braunrost und ermöglichen eine rasche Vermehrung des Rostpilzes. Ein Braunrostbefall im Vorjahr erhöht die Gefahr eines Befalls zusätzlich. Die Krankheit erscheint meistens relativ spät und verursacht deshalb nur selten, ausser bei spät reifenden Sorten, einen ins Gewicht fallenden Ertragsausfall.
Myzel und Uredosporen überleben tiefe Temperaturen problemlos, was dem Rostpilz ermöglicht, auch ohne Zwischenwirt in einer Region zu überleben.
Wirtsspektrum
Der Roggenbraunrost, P. recondita f. sp. secalis, befällt in der Dikaryophase ausschließlich den Kulturroggen.
Zwischenwirte der P. recondita f. sp. secalis sind Ochsenzunge (Anchusa sp.), der Natternkopf (Echium sp.) oder andere Vertreter der Raublattgewächse.
Roggensorten unterscheiden sich in der Anfälligkeit gegenüber Braunrost. Sie tragen ein oder mehrere Resistenzgene. Diese können von bestimmten Braunrostrassen überwunden werden (= Rostrasse ist virulent), was zu einer Infektion und zur Bildung von Uredosporen führt. Pflanzen die Resistenzgene enthalten, welche von dieser bestimmten Rasse nicht überwunden werden können (= Rostrasse ist avirulent), bleiben gesund. Wehling et al. (2003) und Roux et al. (2004) identifizierten fünf verschiedene Resistenzgene auf vier Roggenchromosomen: Pr1 auf dem Chromosom 6RL, Pr2 auf 7RL, Pr3 auf 1RS, Pr4 und Pr5 auf 1RL. Jedes dieser fünf Gene bewirkt eine Resistenz gegen viele Einpustel-Isolate des Roggenbraunrosts. Zwischen den Pr Genen konnten zudem Unterschiede in der Anfälligkeit gegen die verschiedenen Isolate beobachtet werden.
Der Pflanzenzüchter versucht, möglichst breit wirksame Resistenzgene in einer Roggensorte zu vereinen, um diese gegen möglichst viele Rostrassen dauerhaft resistent zu machen. Die Resistenzzüchtung erleidet aber immer wieder Rückschläge, da neue Rostrassen entstehen oder neue Rassen in ein vorher nicht besiedeltes Gebiet einwandern können. Deshalb wird weiterhin in Landrassen, verwandten Arten, Wild- und Urformen des Roggens nach neuen Resistenzgenen gesucht. Neue Resistenzgene sind jedoch meist mit Genen für negative agronomische Eigenschaften gekoppelt, so dass sie nicht genutzt werden können.
Vorbeugende Massnahmen und Bekämpfung
- Die wichtigste Massnahme zur Vermeidung von Ertragseinbussen durch Braunrost ist die Wahl von resistenten, frühreifen Roggensorten. Die Anfälligkeit der Sorten für Braunrost ist für die Schweiz in der Liste der empfohlenen Getreidesorten, für Deutschland in der Sortenliste des Bundessortenamtes und für Österreich in der Österreichischen beschreibenden Sortenliste angegeben.
- Winterroggen nicht zu früh säen und damit Herbstinfektionen vermeiden (Häni et al. 2008)
- Um den Lebenszyklus des Braunrostes zu unterbrechen lohnt es sich, Ausfallroggen und Stoppeln vor dem Auflaufen der Herbstsaat zu vernichten.
- Gut mit Stickstoff versorgter Roggen ist anfälliger für Braunrost, deshalb soll der Stickstoff zurückhaltend eingesetzt und die Einzelgaben nicht zu hoch dosiert werden.
- Braunrost tritt relativ spät auf, weshalb meist keine chemische Bekämpfung nötig ist. In der Schweiz ist die Bekämpfungsschwelle erreicht, falls während der Entwicklungsstadien 37 (Erscheinen des Fahnenblattes) bis 61 (Beginn Blüte) bei anfälligen Sorten 1 bis 4 %, beziehungsweise bei weniger anfälligen Sorten 10 % befallene Blätter vorhanden sind (Agridea, Datenblätter Ackerbau).
- Empfohlene und zugelassene Pflanzenschutzmittel zum Schutz gegen den Roggenbraunrost finden sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit).
Literatur
Anikster Y, Bushnell WR, Eilam T, Manisterski J, Roelfs AP, 1997. Puccinia recondita causing leaf rust on cultivated wheats, wild wheats and rye. Can. J. Bot. 75: 2082-2096.
Gäumann E, 1959. Beiträge zur Kryptogamenflora der Schweiz (Band XII): Die Rostpilze Mitteleuropas, Büchler und Co. 1407 S.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Klocke B, 2004. Virulenzstruktur und –dynamik des Roggenbraunrostes (Puccinia recondita f.sp. secalis in der Bundesrepublik Deutschland. Dissertation Martin-Luther Universität Halle-Wittenberg: 141 S.
Miedaner T, Klocke B, Flath K, Geiger HH, Weber WE, 2012. Diversity, spatial variation, and temporal dynamics of virulences in the German leaf rust (Puccinia recondita f.sp. secalis) population in winter rye. European Journal of Plant Pathology 132: 23-35
Obst A, Paul V, 1993. Krankheiten und Schädlinge des Getreides. Verlag Th. Mann: 184 S.
Roux SR, Hackauf B, Linz A, Ruge B, Klocke B, Wehling P, 2004. Leaf-rust resistance in rye (Secale cereale L.). 2. Genetic analysis and mapping of resistance genes Pr3, Pr4, and Pr5. Theor. Appl. Genet., Band: 110: 192-201
Wehling P, Linz A, Hackauf B, Roux SR, Ruge B, Klocke B, 2003. Leaf-rust resistance in rye (Secale cereale L.). 1. Genetic analysis and mapping of resistance genes Pr1 and Pr2. Theor. Appl. Genet., Band: 107, Heft: 3: 432-438




