Wurzelhals- und Stängelfäule (Phoma)
chancre du collet du colza (franz.); phoma stem canker, black leg (engl.)
wissenschaftlicher Name: Teleomorph: Leptosphaeria maculans (Desm.) Ces. & de Not. und Leptosphaeria biglobosa Shoemaker & H. Brun
Anamorph von L. maculans: Phoma lingam Tode ex Fr.
Taxonomie: Fungi, Ascomycota, Pezizomycotina, Dothideomycetes, Pleosporomycetidae, Pleosporales, Leptosphaeriaceae
Die Wurzelhals- und Stängelfäule (Leptosphaeria maculans, Nebenfruchtform: Phoma lingam) befällt Raps (Brassica napus) und andere Kreuzblütler. Die Pilzkrankheit kommt weltweit vor und kann zu Ertragsverlusten von 10-20 % führen (Häni et al. 2008). Der Erreger verursacht graue Flecken auf Blättern und Stängeln sowie braunes, faulendes Gewebe am Wurzelhals. Auf älteren Flecken sind kleine, schwarze Sporenbehälter (Pyknidien) sichtbar. Sorgfältiges Unterpflügen von Stroh- und Stoppelresten, eine mechanische oder chemische Beseitigung von Ausfallraps, eine geregelte Fruchtfolge mit einem Abstand von 3-4 Jahren zwischen den Rapskulturen und der Anbau wenig anfälliger Sorten beugen einem Befall weitgehend vor.

 Abb. 1. Wurzelhals- und Stängelfäule an Raps verusacht durch Leptosphaeria maculans (Nebenfruchtform Phoma lingam))
Abb. 1. Wurzelhals- und Stängelfäule an Raps verusacht durch Leptosphaeria maculans (Nebenfruchtform Phoma lingam))
Krankheitsbild
Der Erreger der Wurzelhals- und Stängelfäule kann während der gesamten Vegetationsperiode Schäden an Raps verursachen. Symptome können bereits an den Keimblättern oder an den ersten Blättern im Spätsommer beobachtet werden: Erkrankte Keimlinge welken und fallen um.
Im Herbst zeigen die Blätter runde oder unregelmässig geformte Flecken, die von den Blattadern begrenzt werden (Abb. 1 und 2). Die Blattflecken sind zuerst gelblich, später stirbt das Gewebe im Zentrum ab und wird gräulich. Die Flecken haben oft einen dunklen Rand. Innerhalb der Nekrosen wachsen kleine, schwarze Sporenbehälter (Pyknidien), die unter günstigen Bedingungen eine rosa gefärbte Sporenmasse absondern.
Am Wurzelhals bilden sich im Herbst dunkelbraune Flecken.
Im Frühjahr entstehen weitere helle Flecken an Stängeln, Blättern und später auch auf den Schoten (Abb. 1 und 2). Die im Herbst entstandenen dunkelbraunen Flecken am Wurzelhals dehnen sich in Richtung Stängel und Wurzeln aus. Das erkrankte Pflanzengewebe wird rissig und faul. Hier kann der Stängel brechen und umfallen (Umfallkrankheit). Häufig sind auch rissige Verkorkungen am Wurzelhals zu erkennen, durch die das befallene Gewebe abgestossen wird. Die ovalen, hellgrauen bis weisslichen Flecken am Stängel sind durch einen braunschwarzen Rand vom gesunden Gewebe abgegrenzt. Auf älteren Flecken sind Pyknidien sichtbar.
Ein früher Bbefall führt zu reduziertem Schotenansatz und Notreife. Notreife Pflanzen überragen den sich neigenden Bestand (Heitefuss et al. 1993). Die Wurzeln stark befallener Pflanzen faulen vollständig ab. Solche Pflanzen lassen sich leicht aus dem Boden ziehen.
Krankheitserreger
Die Wurzelhals- und Stängelfäule wird durch den Ascomyceten Leptosphaeria maculans verursacht (Nebenfruchtform Phoma lingam). Die Hauptfruchtform (Abb. 3) bildet auf Pflanzenresten kugelige, schwarze Hauptfruchtkörper, sogenannte Pseudothecien, mit einem Durchmesser von 300-500 µm (Rimmer al. 2007). Diese enthalten bitunicate, keulenförmige Asci (15-22 x 80-125 µm) mit Ascosporen. Letztere sind farblos bis gelb-braun, haben fünf Septen und messen 5-8 µm x 35-70 µm. Der Pilz ist haploid und strikt heterothallisch mit bipolaren Kompatibilität.
Die Pyknidien von Phoma lingam, die auf lebendem Pflanzengewebe wachsen, unterscheiden sich morphologisch von denjenigen, welche auf abgestorbenen Pflanzenresten gebildet werden (Rimmer et al. 2007). Erstere sind 200-600 µm gross und haben eine bis zu 18 µm dicke Wand, sind kugelförmig und schwarz (Abb. 4). Pyknidien hingegen, die auf abgestorbenen Pflanzenresten gebildet werden, sind eher Sklerotien ähnlich und unregelmässig geformt. Sie sind 200-500 µm gross und haben eine bis zu 50 µm dicke Wand, die aus mehreren Schichten dickwandiger Zellen besteht.
In den Pyknidien werden massenhaft einzellige, gerade Pyknosporen (Konidien) gebildet. Sie messen 1.2-2 x 3-5 µm (Abb. 5).
Leptosphaeria biglobosa ist ein weiterer Erreger, der an Raps Wurzelhals- und Stängelfäule verursacht (Fitt et al. 2006). Er ist jedoch deutlich weniger aggressiv und verursacht kleinere, dunklere Blattflecken mit wenigen oder keinen Pyknidien.
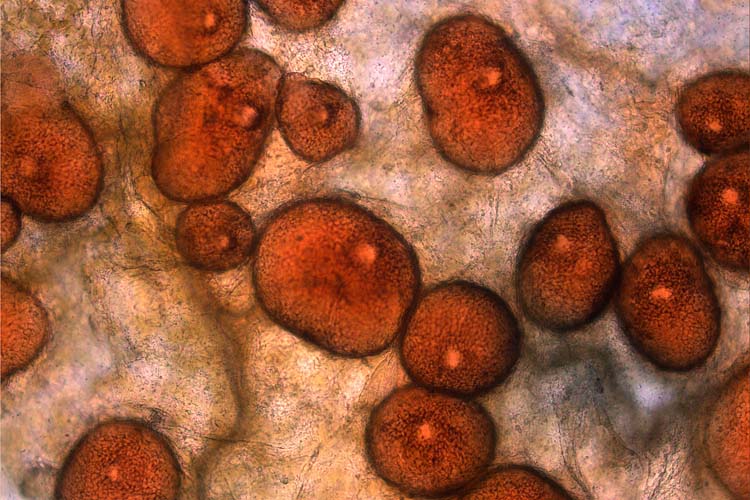 Abb. 4. Kugelförmige Pyknidien der Leptosphaeria maculans (Nebenfruchtform: Phoma lingam) an Raps; im Inneren werden Pyknosporen (=Konidien) gebildet
Abb. 4. Kugelförmige Pyknidien der Leptosphaeria maculans (Nebenfruchtform: Phoma lingam) an Raps; im Inneren werden Pyknosporen (=Konidien) gebildet
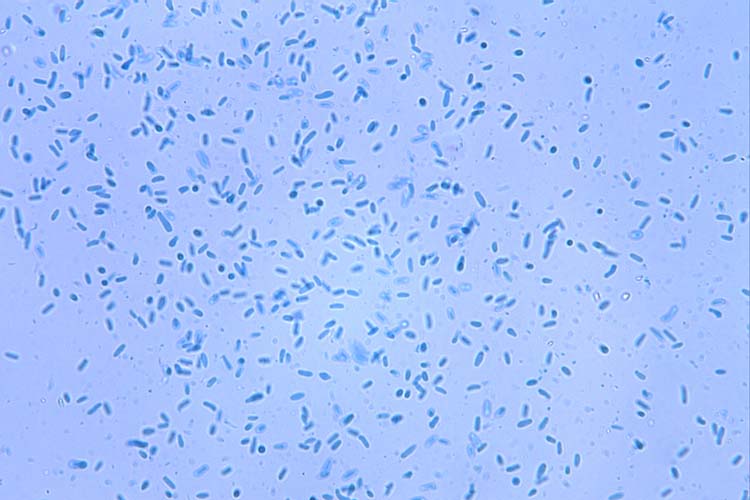 Abb. 5. Pyknosporen (=Konidien) der Leptosphaeria maculans)
Abb. 5. Pyknosporen (=Konidien) der Leptosphaeria maculans)
Lebenszyklus
Der Erreger der Wurzelhals- und Stängelfäule (L. maculans) wächst zunächst saprophytisch auf Stoppelresten alter Rapsbestände, wo er je nach Klima ein bis vier Jahre überleben kann. Hier kommt es auch zur geschlechtlichen Fortpflanzung und damit zur Bildung von Fruchtkörpern (Pseudothecien) mit Asci und Ascosporen (Primärinokulum) (Abb. 3). Die Ascosporen werden im Herbst mit dem Wind über grössere Distanzen (mehrere Kilometer) verbreitet und infizieren bei günstigen Bedingungen die jungen Rapspflanzen. Die Pflanzen sind vom Keimlings- bis zum 6-Blattstadium am anfälligsten. Die Infektion der Pflanzen erfolgt über Spaltöffnungen oder Wunden, die zum Beispiel durch Insekten (Rapserdfloh) verursacht werden. Sie erfolgt bevorzugt am Wurzelhals und an den Blättern. Nach dem Eindringen in die Pflanze lebt der Pilz für kurze Zeit nekrotroph und erzeugt Blattflecken, wo die nicht geschlechtliche Vermehrung in Form von Pyknidien mit Pyknosporen (Konidien) stattfindet. Letztere werden durch Regentropfen auf benachbarte Pflanzen geschleudert und verursachen Sekundärinfektionen. Es wird allerdings angenommen, dass Sekundärinfektionen in West-Europa nur eine untergeordnete Bedeutung im Krankheitsverlauf spielen (Rouxel und Balesdent 2005).
Dem Blattfleckenstadium folgt eine längere endophytische Besiedlung der Rapspflanze. In dieser Zeit sind äusserlich keine Symptome sichtbar: Das Pilzmyzel wächst in den Leitbündeln der Blätter sowie in den Blattstielen und erreicht so den Stängelgrund. Dort bildet das Pflanzengewebe eine ganz spezielle ökologische Nische für L. maculans. Gegen Ende des Wachstums beginnt der Pilz das Pflanzengewebe am Stängelgrund abzutöten, was zum Abknicken der Stängel und zu Ertragsverlusten führt. Nach der Ernte lebt der Pilz als Saprophyt auf den Ernterückständen.
L. maculans kann auch mit infiziertem Saatgut übertragen werden (Heitefuss et al. 1993, Rimmer et al. 2007). Diese Übertragung spielt im Rapsanbau in der Regel keine grosse Rolle. Dies im Gegensatz zum Kohlanbau, wo dieser Übertragungsweg die wichtigste Quelle für Neuinfektionen ist.
Ein Herbstbefall kann auch über Infektionen durch Pyknosporen von Ernterückständen erfolgen.
Epidemiologie
Die Freisetzung von Ascosporen aus den Asci erfolgt zwischen September und November bei Temperaturen zwischen 8 und 15 °C und einer hohen relativen Luftfeuchtigkeit (Rimmer et al. 2007). In dieser Zeit ist Raps, der im Spätsommer gesät wurde, am anfälligsten.
Die Temperatur beeinflusst die Ausbildung der Symptome: Während bei Temperaturen unter 10 °C die Besiedlung der Rapspflanzen meist ohne äusserlich sichtbare Symptome erfolgt, wird die typische Wurzelhals- und Stängelfäule bei Temperaturen über 20 °C sehr schnell sichtbar (Rimmer et al. 2007).
Wirtsspektrum
Das Wirtspflanzenspektrum von L. maculans beschränkt sich auf Kreuzblütler (Brassicaceae, früher Cruciferae), hauptsächlich auf Brassica Arten. Neben Raps (Brassica napus) und Rübsen (B. rapa) werden auch alle Kohlarten (B. oleracea), Leindotter (Camelina sativa), Rettich oder Radieschen (Raphanus sativus), weisser Senf (Sinapis alba) und andere Kreuzblütler mehr oder weniger stark befallen.
Vorbeugende Massnahmen und Bekämpfung
- Eine Infektion junger Rapsbestände im Herbst geht meist von infizierten Ernterückständen alter Rapsbestände aus. Alle ackerbaulichen Massnahmen, die zu einer raschen Beseitigung der Stroh- und Stoppelresten führen, verringern daher das Infektionsrisiko für den in der Nähe ausgesäten Raps. Sorgfältiges Unterpflügen der Rapsernterückstände fördert deren Verrottung, verhindert die Freisetzung von Ascosporen im Herbst und vermindert so die Infektionsgefahr.
- Ausfallraps neben der neuen Rapsfläche muss rechtzeitig beseitigt werden (mechanisch oder chemisch). Ansonsten ist in feuchten Jahren ein Befall mit Wurzelhals- und Stängelfäule garantiert.
- Innerhalb der Fruchtfolge wird ein zeitlicher Abstand von 3 bis 4 Jahren zwischen den Rapskulturen empfohlen, damit in der Zwischenzeit Stroh- und Stoppelreste abgebaut werden und keine Infektionsquelle mehr darstellt. In Regionen mit verstärktem Rapsanbau besteht jedoch immer ein erhöhter Infektionsdruck.
- Sortenwahl: Einige empfohlene Rapssorten weisen eine sehr gute bis gute Resistenz gegen die Wurzelhals- und Stängelfäule auf (Schweiz: Liste der empfohlenen Winterrapssorten; Österreich: Österreichische beschreibende Sortenliste).
- Der Erreger der Wurzelhals- und Stängelfäule kann über Verletzungen, verursacht durch Schädlinge (Erdflöhe u.a.), in die Pflanze eindringen. Eine Kontrolle der Rapsschädlinge kann daher einen Befall mi L. maculans Befall reduzieren.
- Eine direkte Bekämpfung mit Fungiziden wird nur bei sichtbarem, starkem Befall im Herbst von anfälligen Sorten empfohlen (Häni et al. 2008). Einige Fungizide, die im Herbst oder Frühling zur Bekämpfung der Wurzelhals und Stängelfäule (Phoma lingam) eingesetzt werden können, wirken auch als Wachstumsregler. Sie hemmen das Längenwachstum, reduzieren das Schossen im Herbst und fördern das Wurzelwachstum. Ein Überwachsen der Rapsbestände kann so verhindert werden. Frühe Behandlungstermine (4. Laubblattstadium des Rapses) sind anzustreben.
- Empfohlene und zugelassene Pflanzenschutzmittel gegen die Wurzelhals- und Stängelfäule finden Sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit).
Literatur
Fitt BDL, Brun H, Barbetti MJ, Rimmer SR, 2006. World-wide importance of phoma stem canker (Leptosphaeria maculans and L. biglobosa) on oilseed rape (Brassica napus). European Journal of Plant Pathology 114: 3-15.
Häni FJ, Popow G, Reinhard H, Schwarz A und Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Heitefuss R, König K, Obst A, Reschke M, 1993. Pflanzenkrankheiten und Schädlinge im Ackerbau. DLG-Verlags-GmbH.
Rimmer SR, Shattuck VI, Buchwaldt L, 2007. Compendium of Brassica Diseases. The American Phytopathological Society Press, St. Paul: 117S.
Rouxel T, Balesdent MH, 2005. The stem canker (blackleg) fungus, Leptosphaeria maculans, enters the genomic era. Molecular Plant Pathology 6 (3): 225-241.



