Erbsenblattlaus
Puceron vert du pois (franz.); pea aphid (engl.)
wissenschaftlicher Name: Acyrthosiphum pisum Harris
Synonyme: Macrosiphum pisi Kalt., Acyrthosiphum onobrychis Boy., Macrosiphum pisum Harr.
Taxonomie: Animalia, Arthropoda, Insecta, Pterygota, Hemiptera, Aphididae
Die Erbsenblattlaus (Acyrthosiphum pisum) schädigt die Pflanzen durch ihre Saugtätigkeit andererseits ist sie auch ein wichtiger Überträger von Pflanzenviren. Sie befällt neben Erbsen auch Ackerbohnen, Luzerne, Rotklee und anderen Kleearten. Nützlinge und insektenpathogene Pilze können oft die Massenentwicklung begrenzen.

Abb. 1. Erbsenblattlaus (Acyrthosiphon pisum)
Schaden
Die ersten Erbsenblattläuse befinden sich zunächst im Verborgenen zwischen den noch nicht entfalteten Blättern der Triebspitze (Abb. 1 und 2). Durch die Saugtätigkeit der Blattläuse wird die Pflanze geschädigt. Die Triebspitzen welken, die Pflanze wächst langsamer und die Blätter werden gelb. Früh befallen können junge Pflanzen sogar absterben. Die Anzahl Hülsen ist reduziert, ebenso die Anzahl Körner pro Hülse. Die Körner bleiben klein. Die Blattläuse scheiden Honigtau ab, der die Blätter mit einer glänzenden, klebrigen Schicht überzieht und häufig von Russtaupilzen besiedelt wird.
Die Erbsenblattläuse können Pflanzenviren übertragen, zum Beispiel das Blattroll-Virus der Ackerbohne, das Scharfe Adernmosaik-Virus, das Erbsenmosaik-Virus, das Luzernemosaik-Virus oder das Bohnengelbmosaik-Virus. Je nach Virus sind die Beeinträchtigungen der Erbsenpflanze unterschiedlich.
Beschreibung der Erbsenblattlaus
Die ungeflügelte Erbsenblattlaus ist 3.3 bis 5.1 mm lang und gehört damit zu den grossen Blattlausarten (Dubnik 1991). Es gibt grüne, gelb-grüne oder rote Tiere. Die Fühler sind deutlich länger als der Körper. Die Spitze der Fühler und der einzelnen Fühlerglieder sind dunkelbraun. Die sehr langen und dünnen Hinterleibsröhren (Siphonen) sind am Ende bräunlich. Das Schwänzchen (Cauda) ist ebenfalls lang und am Ende spitz.
Die geflügelten Formen messen 3.1 bis 4.1 mm und sind schwach pigmentiert. Im Gegensatz zu den Ungeflügelten sind die Fühler, Beine und Schwänzchen dunkler. Die Augen sind rot.
Entwicklungszyklus
Die Erbsenblattlaus weist einen vollständigen Lebenszyklus auf. Nach der Paarung der Männchen mit den geschlechtlichen Weibchen werden im Herbst befruchtete Eier an ausdauernde Vicia Arten oder an Rotklee abgelegt. Ein Weibchen kann bis zu 10 Eier legen (Hoffmann und Schmutterer 1999). Diese schwarzen Eier überwintern. In Gegenden mit milden Wintern (Südeuropa) kann die Erbsenblattlaus auch als lebendgebärendes Weibchen überwintern.
Im Frühjahr (April bis Mai) schlüpfen die Larven aus den Eiern und entwickeln sich zu ungeflügelten Stammmüttern (Fundatrix), die sich ungeschlechtlich (parthenogenetisch) vermehren. Ab der zweiten Generation treten erste geflügelte Tiere auf. Diese wandern ab zu den Erbsen- oder Ackerbohnenbeständen.
Bei günstigem Wetter kommt es hier zur Massenvermehrung. Ein Weibchen kann pro Tag mehr als zehn Jungtiere absetzen (Kühne et al. 2006). In den Blattlauskolonien entstehen laufend geflügelte Weibchen, die neue Erbsenpflanzen besiedeln. Nach dem Abreifen der Erbsenfelder bricht die Blattlauspopulation zusammen. Die geflügelten Weibchen fliegen ausdauernde Leguminosen an. Dort entstehen neben den Männchen auch geschlechtliche Weibchen.
Wirtsspektrum
Die Erbsenblattlaus ist an verschiedenen Schmetterlingsblütlern zu finden: Erbsen, Ackerbohnen, Luzerne, Rotklee und anderen Kleearten (Dubnik 1991).
Bekämpfung
- Neuansaaten von Erbsen nicht unmittelbar neben Kleegras- oder Luzerneschlägen planen.
- Erbsen früh oder spät säen. Die empfindliche Phase der Hülsenbildung ist dann zur Zeit der Massenentwicklung der Erbsenblattlaus weitgehend abgeschlossen oder noch nicht erreicht.
- Förderung von Nützlingen: Marienkäfer, Larven von Schweb- und Florfliegen, Schlupfwespen und insektenpathogene Pilze (Entomophthora Pilze) (Häni et al. 2008)
- Ab Blühbeginn Einsatz von nützlingsschonenden Insektiziden (Brenner und Hochstrasser 2015). Bekämpfungsschwellen beachten!
Literatur
Brenner H, Hochstrasser M, 2015. Pflanzenschutzmittel im Feldbau. Fachstellen Pflanzenschutz Thurgau und Strickhof. 106 S.
Dubnik H, 1991. Blattläuse: Artenbestimmung – Biologie – Bekämpfung. Verlag Th. Mann Gelsenkirchen-Buer: 120 S.
Häni FJ, Popow G, Reinhard H, Schwarz A und Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Hoffmann GM, Schmutterer H, 1999. Parasitäre Krankheiten und Schädlinge an landwirtschaftlichen Kulturpflanzen. Verlag Eugen Ulmer Stuttgart (2. Auflage): 675 S.
Kühne S, Burth U, Marx P, 2006. Biologischer Pflanzenschutz im Freiland. Eugen Ulmer KG: 288 S.







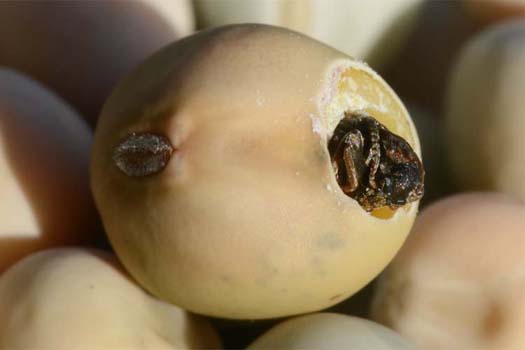 Abb. 1. Erbsenkäfer (Bruchus pisorum) kurz vor dem Verlassen des Samens
Abb. 1. Erbsenkäfer (Bruchus pisorum) kurz vor dem Verlassen des Samens


























