DTR-Blattdürre
DTR-Blattdürre oder Helminthosporium Blattflecken (de); helminthosporiose du blé (fr.); tan spot or yellow leaf spot (engl.)
Wissenschaftlicher Name:
Hauptfruchtform (sexuelle Fortpflanzungsform = Teleomorphe): Pyrenophora tritici-repentis (Died.) Drechsler
Nebenfruchtform (asexuelle Fortpflanzungsform = Anamorphe): Drechslera tritici-repentis (Died.) Shoemaker
Synonyme: Helminthosporium tritici-repentis Died., Drechslera tritici-vulgaris (Y. Nisik.) S. Ito, Pleospora tritici-repentis Died., Pyrenophora sarcocystis (Berk. & M.A. Curtis) Ravenel, Pyrenophora trichostoma (Fr.) Sacc., Pyrenophora tritici-vulgaris J.G. Dick
Taxonomie: Fungi, Ascomycota, Dothideomycetes, Pleosporomycetidae, Pleosporales, Pleosporaceae
Pyrenophora tritici-repentis (Nebenfruchtform: Drechslera tritici-repentis = DTR) löst an Weizen eine Blattdürre aus. Der Krankheitserreger kommt weltweit in allen Weizenanbaugebieten vor und verursacht im Durchschnitt 5-10 % Ertragsausfälle (Singh et al. 2010). P. tritici-repentis mindert die Qualität der Weizenkörner, führt zu Kümmerkörnern sowie zu einer rötlichen Verfärbung der Körner. Der Anbau von weniger anfälligen Sorten, eine angepasste Fruchtfolge und das Einarbeiten von Stoppelresten können einen Befall durch P. tritici-repentis weitgehend verhindern.
 Abb. 1. DTR-Blattdürre, verursacht durch Pyrenophora tritici-repentis: Primärinfektion an bodennahen Blättern
Abb. 1. DTR-Blattdürre, verursacht durch Pyrenophora tritici-repentis: Primärinfektion an bodennahen Blättern


 Abb. 2. DTR-Blattdürre an Weizen, verursacht durch Pyrenophora tritici-repentis (Mischinfektion mit Septoria tritici, unteres Bild)
Abb. 2. DTR-Blattdürre an Weizen, verursacht durch Pyrenophora tritici-repentis (Mischinfektion mit Septoria tritici, unteres Bild)
Krankheitsbild
Die ersten Symptome der DTR-Blattdürre erscheinen an den bodennahen Blättern als hellbraune, rundliche bis unregelmässige Flecken, die sich spindelförmig ausdehnen (Abb. 1 und 2). Die Blattflecken (Augenfleck) haben ein dunkelbraunes Zentrum und sind umgeben von einer gelben, chlorotischen Zone (verursacht durch Toxine des Pilzes). Die Symptome können je nach Weizensorte, beziehungsweise vorhandener Resistenzgene, variieren: Nicht immer ist eine gelbe Zone oder ein dunkelbraunes Zentrum sichtbar. Auf resistenten Weizenpflanzen entwickeln sich nur kleine braune Flecken. Auf anfälligen Weizenblättern sind die dunkelbraunen Blattflecken umgeben von hellbraunen Nekrosen und / oder grossflächigen Chlorosen, die sich über das ganze Blatt ausbreiten können.
Zuerst werden die unteren Blätter befallen, später verursacht die DTR-Blattdürre auch an den oberen Blättern (inklusive Fahnenblatt) Symptome. Unter günstigen Umweltbedingungen entwickelt sich der Pilz rasch und einzelne Blattflecken verschmelzen. Das Blatt vergilbt ausgehend von der Blattspitze, wird dürr und stirbt ab.
Die Konidienträger von P. tritici-repentis sind mit einer guten Handlupe als dunkle Striche erkennbar. Eine sichere Diagnose ist nur mit Hilfe eines Mikroskops möglich.
Mögliche Verwechslungen: Die Symptome der DTR-Blattdürre können mit denjenigen der Septoria-Blattdürre (Mycosphaerella graminicola = Septoria tritici) oder denjenigen der Blatt- und Spelzenbräune (verursacht durch Stagonospora (= Septoria) nodorum) verwechselt werden: Bei mindestens 30facher Vergrösserung können die Vermehrungsorgane aber eindeutig voneinander unterschieden werden.
Krankheitserreger
Nebenfruchtform Drechslera tritici-repentis: Die septierten, hellbraunen Konidienträger entstehen einzeln oder in Gruppen zu 2 bis 3 Trägern und wachsen durch Spaltöffnungen (Stomatas) nach aussen (Abb. 3). Sie sind gerade oder gekrümmt, manchmal auch leicht geknickt und an der Basis oft angeschwollen. Ihre Länge beträgt durchschnittlich 250 µm (gelegentlich bis zu 400 µm) und sie sind 6-12 µm dick (Ellis 1971). Die wenigen Narben an der Abrissstelle der Konidien sind unauffällig.
Die Konidien wachsen einzeln, sind dünnwandig, gerade oder leicht gekrümmt, zylinder- förmig und an der Spitze rundlich (Abb. 4). Die Konidienbasis ist deutlich kegelförmig und an der Stelle zwischen Basissegment und Rest der Konidie oft eingeengt: die Basis ist schlangenkopfförmig (shape of a snake's head). Die Konidien besitzen 1-9 (meistens 5-7) Pseudosepten, sind 80-250 (im Durchschnitt 117) µm lang und 14-20 (17.7) µm breit, das Hilum ist 2-4 µm breit (Ellis 1971). Ältere Konidien sind zwischen den Segmenten oft verengt.
Hauptfruchtform Pyrenophora tritici-repentis: Die im Verlauf der geschlechtlichen Vermehrung gebildeten, schwarzen Fruchtkörper (= Pseudothecien) messen im Durchmesser 200-350 µm (Abb. 5). Rund um die schnabelförmigen Öffnungen sind schwarze Stacheln vorhanden (Abb. 6). Die Pseudothecien enthalten bitunikate Asci mit normalerweise je 8 Ascosporen (Abb. 7). Die Fruchtkörper sind braun, oval bis kugelförmig und 18-28 x 45-70 µm gross (Bockhus et al. 2010). Die Ascosporen haben drei Quersepten und sind bei den Septen leicht eingeschnürt. Die mittlere Zelle ist zudem mit einer (selten zwei) Längssepte unterteilt (Abb. 6).
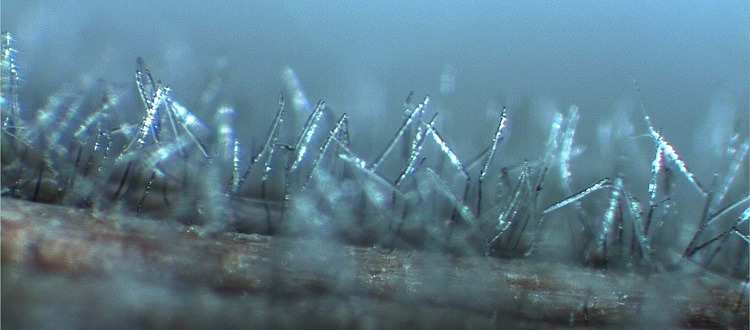 Abb. 3. Konidienträger mit Konidien der Pyrenophora tritici-repentis
Abb. 3. Konidienträger mit Konidien der Pyrenophora tritici-repentis
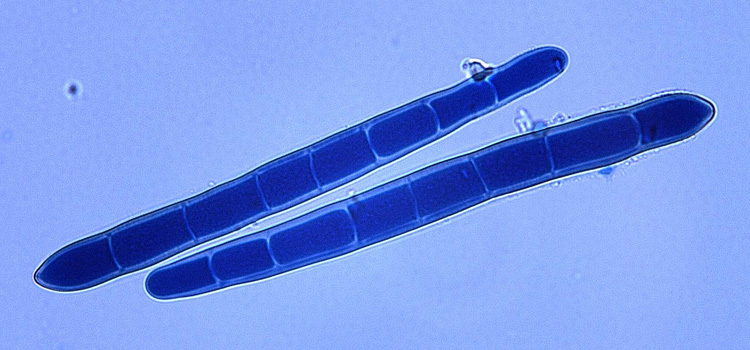 Abb. 4. Konidien (gefärbt) der Pyrenophora tritici-repentis
Abb. 4. Konidien (gefärbt) der Pyrenophora tritici-repentis
Lebenszyklus
P. tritici-repentis überwintert als Myzel oder als Pseudothecien (Fruchtkörper) auf Stroh- und Stoppelresten. Die schwarzen Fruchtkörper, in denen während des Winters die Asci heranreifen, sind im Frühjahr auf den Ernterückständen deutlich zu erkennen. Die Asci entlassen im Frühling bei genügend Feuchtigkeit (Tau reicht aus) Ascosporen. Diese infizieren die Weizenpflanzen in der näheren Umgebung. Primärinfektionen können auch von überwinterndem Myzel über neu gebildete Konidien erfolgen. Schon wenige Tage nach der Primärinfektion entstehen hellbraune Flecken auf denen neue Konidien gebildet werden. Diese werden mit dem Wind, auch über grössere Distanzen, verbreitet und lösen Sekundärinfektionen aus.
Der Krankheitserreger dringt mit Hilfe von Enzymen direkt durch die Epidermis und wächst interzellulär durch das Blattgewebe. Bei günstigen Witterungsbedingungen besiedelt er die Weizenblätter innerhalb sehr kurzer Zeit. Während dieser parasitischen Phase verursacht er grosse Gewebeschädigungen, die durch verschiedene Toxine verursacht werden. P. tritici-repentis kann aber auch als Saprophyt auf abgestorbenem Wirtspflanzenmaterial überleben.


 Abb. 5. Pseudothecien der Pyrenophora tritici-repentis auf Weizenstroh
Abb. 5. Pseudothecien der Pyrenophora tritici-repentis auf Weizenstroh
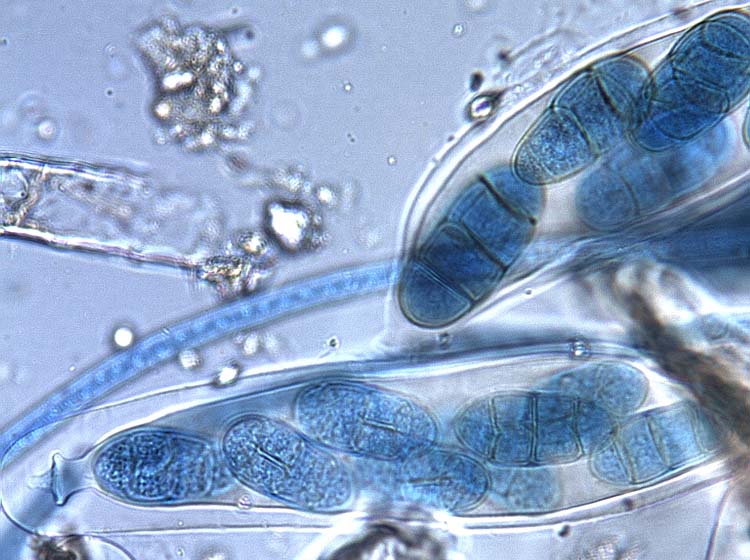
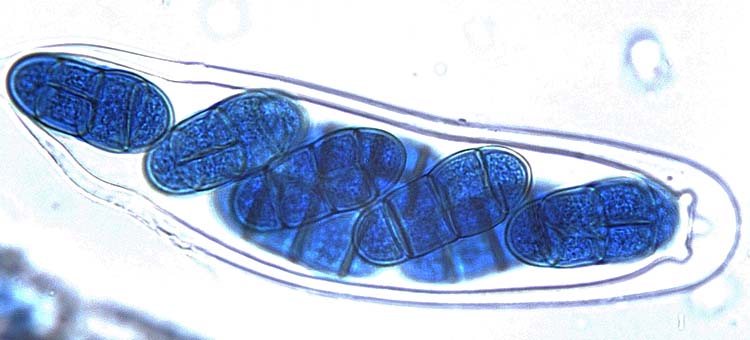 Abb. 6. Asci mit Ascosporen der Pyrenophora tritici-repentis
Abb. 6. Asci mit Ascosporen der Pyrenophora tritici-repentis
Vorkommen und Bedeutung
In Jahre 1923 wurde P. tritici-repentis erstmals beschrieben. Anfänglich galt dieser Krankheitserreger nicht als Weizenschädling. Erst 1940 wurden aus den USA Schäden an Weizen gemeldet, später auch aus Kanada, Südamerika, Australien und Zentralasien (Ciuffetti und Tuori 1999) und Europa. Die gemeldeten Ertragseinbussen bewegten sich in der Grössenordnung von 3 bis 50 %.
Diese plötzliche Zunahme erklärte man sich mit einer weltweit veränderten Bewirtschaftung der Weizenfelder (Ciuffetti und Tuori 1999): Das Stehenlassen von Weizenstoppeln beim pfluglosen Anbau, das Unterlassen des Abbrennens der Stoppeln aus Umweltschutzgründen (Australien), der ununterbrochene Weizenanbau auf der gleichen Fläche und der Anbau von anfälligen Weizensorten trugen wesentlich dazu bei, dass P. tritici-repentis sich ausbreiten konnte.
Nach Friesen et al. (2006) hat P. tritici-repentis das Gen ToxA durch horizontale Genübertragung von Stagonospora (= Septoria) nodorum übernommen, da beide Weizenpathogene das exakt gleich Gen besitzen. Die fehlende Variation in der Sequenz des Gens ToxA von P. tritici-repentis deutet darauf hin, dass die horizontale Genübertragung wahrscheinlich erst vor kurzem stattgefunden hat. Das Produkt von ToxA hilft der P. tritici-repentis den Weizen zu infizieren, allerdings nur, wenn die Weizensorte das (Anfälligkeits-) Gen Tsn1 trägt. Möglicherweise ist dieser horizontale Gentransfer auch eine Erklärung für die rasche Zunahme der weltweiten Bedeutung der DTR-Blattdürre.
Rassen und Resistenz
Rassen unterscheiden sich in ihrer Fähigkeit, bestimmte Weizensorten zu befallen oder nicht zu befallen. Mit Hilfe eines Testsortiments bestehend aus vier (hexaploiden) Weizen- und zwei (tetraploiden) Hartweizenlinien konnten acht verschiedene Rassen der P. tritici repentis unterschieden werden (Lamari et al. 2003; Singh et al. 2010). Die Unterscheidung der Rassen basierte auf den verursachten Symptomen. Je nach Rasse zeigten die Testpflanzen nach einer Infektion Nekrosen, Chlorosen oder keine Symptome (Pflanzen sind resistent). Auslöser dieser unterschiedlichen Symptome sind wirtsspezifische und -unspezifische Toxine, die von Virulenzgenen des Pathogens gesteuert werden (eine bestimmte Rasse enthält ein bis fünf Virulenzgene). Bis heute (2012) sind drei solcher Toxine bekannt und charakterisiert: Ptr ToxA verursacht Nekrosen, Ptr ToxB und Ptr ToxC verursachen Chlorosen an anfälligen Sorten. Daneben sind auch noch einige andere, unbekannte Toxine (wirtsspezifische und wirtsunspezifische) für die Ausprägung der Krankheitssymptome verantwortlich.
Die Toxine sind beteiligt an der Entstehung der Krankheit (Pathogenese). Diese entwickelt sich aber nur, falls die befallene Pflanze ein Anfälligkeitsgen trägt, welches einen spezifischen Rezeptor für das Toxin produziert. Fehlt ein Anfälligkeitsgen, ist die Pflanze resistent.
Resistenzen wurden in vielen Wild- und Kulturformen des Weizens gefunden. Singh et al. (2006) untersuchten total 126 Weizensorten und fanden 10, die gegen mehrere Rassen der P. tritici-repentis äusserst resistent waren. Dank genetischer Untersuchungen von resistenten Weizen konnten sechs Resistenzgene (Tsr1 bis Tsr5 gegen Nekrose, Tsr6 gegen Chlorose verursachende Rassen) identifiziert werden (Tsr = tan spot resistance), die alle rezessiv vererbt werden (Singh et al. 2010). Zusätzlich wurden aber auch andere Resistenzgene und QTLs entdeckt, was auf einen vielseitigen Resistenzmechanismus hindeutet.
Eine einmal erreichte Resistenz in Weizen gegen alle Rassen wäre wahrscheinlich sehr dauerhaft und könnte von P. tritici-repentis kaum überwunden werden. Das Pathogen müsste ein neues Toxin bilden und gleichzeitig müsste der Weizen einen spezifischen Rezeptor für dieses Toxin ausprägen, damit sich die Krankheit entwickeln kann.
Epidemiologie
P. tritici repentis befällt den Weizen während der ganzen Vegetationsperiode, vorwiegend aber im Frühjahr und zu Beginn des Sommers. Die Bildung der Konidien erfolgt bei feuchtwarmem Wetter (Optimum 21-23 °C) und die Sporen werden bei trockener Witterung durch Wind verbreitet. Für eine erfolgreiche Infektion sind 6 bis 48 Stunden Blattnässe erforderlich (Tau reicht aus). Bei Temperaturen zwischen 20-25 °C erscheinen nach 3-4 Tagen die ersten Krankheitssymptome, nach 6-8 Tagen werden die ersten neuen Konidien gebildet. Warme, wechselfeuchte Witterung mit ausreichender Taubildung begünstigt die epidemische Ausbreitung.
Weizen nach Weizen, Ernterückstände auf der Bodenoberfläche, anfällige Sorten und verseuchtes Saatgut sind weitere Faktoren, welche die DTR-Blattdürre begünstigen.
Die Tatsache, dass P. tritici-repentis viele Grasarten befällt (z.B. auch die Quecke, Agropyron repens), erleichtert dem Pilz die Überwinterung. Im Frühjahr ist Primärinokulum vorhanden, was sich auf eine DTR-Blattdürre-Epidemie günstig auswirkt. Der Pilz kann sich auch saprophytisch ernähren und den Winter als Myzel auf abgestorbenen Pflanzenteilen überdauern.
Wirtsspektrum
P. tritici-repentis befällt Weizen (Triticum aestivum), Hartweizen (T. durum), Triticale (x Triticosecale) und Roggen (Secale cereale) sowie mindestens 25 andere Pflanzenarten (Krupinsky 1992). Gerste und Hafer sind resistent (Bockhus et al. 2010).
Vorbeugende Massnahmen und Bekämpfung
- Der Krankheitserreger Pyrenophora tritici-repentis kann an der Bodenoberfläche auf Stroh- und Stoppelresten überleben. Der Anbau von Weizen nach Weizen sollte deshalb möglichst vermieden oder die Stoppelresten sollten sorgfältig eingearbeitet werden (keine Minimalbodenbearbeitung!). Eine Gründüngung wirkt sich auf das Bodenleben günstig aus und hilft, befallenes Pflanzenmaterial schnell abzubauen.
- Die ökonomisch und ökologisch sinnvollste Methode, die Ausbreitung der DTR-Blattdürre zu verhindern, ist die Wahl wenig anfälliger Sorten. Sie werden zwar befallen, die Verletzungen wachsen aber wesentlich langsamer. Die Anfälligkeit der Sorten für die DTR-Blattdürre ist für Deutschland in der Sortenliste des Bundessortenamtes und für Österreich in der Österreichischen beschreibenden Sortenliste beschrieben.
- P. tritici-repentis wird mit dem Saatgut übertragen. Aus diesem Grunde lohnt es sich, zertifiziertes Saatgut zu verwenden.
- In hoch anfälligen Weizenbeständen ist wegen der möglichen schnellen Ausbreitung eine rasche Bekämpfung notwendig. Sobald der Schaderreger auf ersten Blattflecken Sporenträger und Konidien gebildet hat und gleichzeitig eine wechselfeuchte und warme Witterung vorherrscht, sind die Bedingungen für eine weitere Ausbreitung günstig.
In der Schweiz sind Betriebe, die gemäss dem ökologischen Leistungsnachweis (ÖLN) wirtschaften, verpflichtet, Pflanzenschutzmittel nur gemäss dem Schadschwellenprinzip anzuwenden. Schadschwellen, beziehungsweise Bekämpfungsschwellen, geben einen Anhaltspunkt, bei welcher Dichte eine Bekämpfung mit Pflanzenschutzmitteln erfolgen soll und wirtschaftlich sinnvoll ist.
Die Bekämpfungsschwelle für Blattflecken an Weizen, Triticale und Roggen ist in der Schweiz wie folgt festgesetzt (Agridea, Datenblätter Ackerbau): Während der Entwicklungsstadien 37 (Fahnenblattspitze sichtbar) bis 51 (Beginn Ährenschieben) wird jeweils das 4. oberste Blatt von 100 Halmen ausgezählt. Blattflecken verursacht durch DTR Blattdürre (Drechslera tritici-repentis), Septoria Arten (S. tritici und S. nodorum) werden zusammengezählt. Die Bekämpfungsschwelle ist erreicht, falls 20 Blätter (= 20%) befallen sind. - Empfohlene und zugelassene Pflanzenschutzmittel gegen die DTR Blattdürre finden sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit). Die Anzahl resistenter Isolate von P. tritici-repentis gegen einige Strobilurine hat in letzter Zeit stark zugenommen. Es wird befürchtet, dass diese wichtige Wirkstoffgruppe in Zukunft bei der Bekämpfung der DTR-Blattdürre nicht mehr wirkt.
Literatur
Agridea, 2021. Datenblätter Ackerbau. AGRIDEA, CH-8315 Lindau (Bekämpfungsschwellen)
Bockus WW, Bowden RL, Hunger RM, Morrill WL, Murray TD, Smiley RW, 2010. Compendium of wheat Diseases and Pests. Third edition. The American Phytopathological Society, St. Paul Minnesota: 171 p.
Ciuffetti LM, Tuori RP, 1999. Advances in the Characterization of the Pyrenophora tritici-repentis – Wheat Interaction. Phytopathology 89 (6): 444-449.
Ellis MB, 1971. Dematiaceus Hyphomycetes. Commenwealth Mycological Institute Kew, Surrey England: 608 p.
Friesen TL, Stukenbrock EH, Liu Z, Meinhardt S, Ling H, Faris JD, Rasmussen JB, Solomon PS, McDonald BA, Oliver RP, 2006. Emergence of a new disease as a result of interspecific virulence gene transfer. Nature Genetics Vol. 38 (8): 953-956.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Krupinsky JM, 1992. Grass hosts of Pyrenophora tritici-repentis. Plant Disease 76: 92-95.
Lamari L, Strelkov SE, Yahyaoui A, Orabi J, Smith RB, 2003. The identification of two new races of Pyrenophora tritici-repentis from the host center of diversity confirms a one-to-one relationship in tan spot of wheat. Phytopathology 93: 391-396.
Singh PK, Mergoum M, Ali S, Adhikari TB, Elias EM, Anderson JA, Glover KD, Berzonsky WA, 2006. Evaluation of elite wheat germplasm for resistance to tan spot. Plant Disease 90: 1320-1325.
Singh PK, Singh RP, Duveiller E, Mergoum M, Adhikari TB, Elias EM, 2010. Genetics of wheat-Pyrenophora tritici-repentis interactions. Euphytica 171: 1-13.
